
С 23 по 26 мая 2023 г. в Москве состоялся X (XXIX) Национальный конгресс эндокринологов с международным участием «Персонализированная медицина и практическое здравоохранение». Рассказываем об основных событиях, новостях конгресса и инновациях в диабетологии.
Традиционно ежегодный конгресс эндокринологов открыл академик РАН И.И. Дедов. В своем выступлении он отметил, что распространенность СД 1-го типа составляет 155 на 100 тысяч детского населения. Особое внимание в своем выступлении он уделил патогенезу развития СД 1-го типа. Гибель β-клеток поджелудочной железы в островках Лангерганса обусловлена разрушающим влиянием собственного иммунитета. После воздействия триггерного фактора и повышения уровня глюкозы в крови происходит дополнительная стимуляция выделения инсулина В-лимфоцитами, однако после истощения β-клеток поджелудочной железы сохраняется лишь остаточная секреция инсулина, что приводит к выраженной гипергликемии и развитию кетоацидоза. На настоящий момент зарегистрировано 870 семей, где 1288 детей имеют СД 1-го типа, 552 семьи с 2 и более детьми, страдающими нарушением углеводного обмена, и 318 семей, в которых СД 1-го типа имеют один ребенок и один из родителей. С целью персонализации медицины, позволяющей максимально нивелировать риски СД 1-го типа до уровня популяционных значений, ведется индивидуальный мониторинг здоровья.
Индивидуальный риск возникновения заболевания рассчитывается с учетом популяционного риска (0,2%), среднего риска для родственников 1-й степени родства (5%), HLA идентичных сибсов (16–18%), наличия двоих родителей с СД 1-го типа (34%), предрасполагающих HLA-гаплотипов (18–50%), присутствия патогномоничных антител ICA, GADA, IAA, IA2+HLA (40–70%), снижения 1-й фазы инсулиновой секреции (70–90%). Профилактическая программа в группах повышенного риска возникновения СД 1-го типа включает в себя мониторинг гликемии (в том числе с использованием непрерывного мониторинга уровня глюкозы крови (НМГ)), обучение, мотивацию, индивидуально подобранную диету и физическую активность, распорядок дня, программу интеллектуального развития, выбор профессии с учетом реальных способностей и амбиций ребенка, определение функционального состояния β-клеток поджелудочной железы, клэмп-технологии, а также постоянное информационное сопровождение ребенка и его семьи. Реализация поставленных задач требует междисциплинарного подхода и активного участия детского эндокринолога, педиатра, психолога/психотерапевта, диетолога, реабилитолога, специалиста по оздоровительной физкультуре и др.
С 2000 по 2022 г. в России определяется выраженный рост распространенности СД. Так, если в 2000 г. количество пациентов с СД составляло 2,04 миллиона людей, то в 2022 г. эта цифра увеличилась до 4,96 миллионов человек. Таким образом, прирост СД 1-го типа составил 55,1%, а СД 2-го типа – 30%. В 2022 г. было впервые выявлено 11 848 случаев СД 1-го типа и 277 573 случаев СД 2-го типа. Во время пандемии коронавирусной инфекции отмечен спад заболеваемости СД 2-го типа и значительный рост смертности среди пациентов с СД как 1-го, так и 2-го типов. Наибольший прирост до 10,4% для СД 1-го типа и 25,3% для СД 2-го типа был выявлен в период 2020–2021 гг. с постепенным возвращением показателей к прежним значениям в последующие годы. Основной причиной смерти пациентов с СД продолжают оставаться болезни системы кровообращения, в результате которых погибло 38,6% пациентов с СД 1-го типа и 50,9% пациентов с СД 2-го типа. При этом количество людей, умерших вследствие острых и хронических осложнений СД, занимает значительно меньшую долю в кумулятивной структуре смертности: суммарно 7,3% при СД 1-го типа и лишь 2,5% при СД 2-го типа.
В настоящее время доля лабораторного исследования уровня гликированного гемоглобина (Hb1Ac) составляет менее 50% при обоих типах СД (44% при СД 1-го типа и 34% при СД 2-го типа). Показатель не указывается практически у каждого второго пациента с СД: у 43% пациентов с СД 1-го типа и 49% СД 2-го типа. Предпочтительной является оценка Hb1Ac лабораторным методом, при этом расчет суррогатного Hb1Ac по уровню среднесуточной гликемии остается доступным в системе регистра, но не учитывается при подсчете доли пациентов с достижением целевых показателей.
Все чаще пациенты получают инновационные препараты для лечения СД: агонисты рецепторов глюкагоноподобного пептида-1 (арГПП-1), ингибиторы натрий-глюкозного контранспортера 2-го типа, ингибиторы дипептидилпептидазы 4-го типа. Продолжается увеличение доли использования аналогов инсулина в период 2010–2022 гг., прирост которых составил +41,1% (до 83,6%) при СД 1-го типа и +28% при СД 2-го типа.
В 2022 г. в стандартах ADA была добавлена рекомендация относительно использования инсулина и комбинированной терапии с арГПП-1 для большей эффективности и стойкости эффекта лечения. Терапевтический потенциал арГПП-1 при СД 2 типа выражен в увеличении синтеза и секреции инсулина, улучшении функции β-клеток (увеличение чувствительности к глюкозе, отношения проинсулин/инсулин), замедлении эвакуации пищи из желудка, усилении чувства сытости, снижении аппетита, а, следовательно, снижении приема пищи и массы тела, также отмечаются положительные сердечно-сосудистые эффекты, улучшение чувствительности к инсулину.
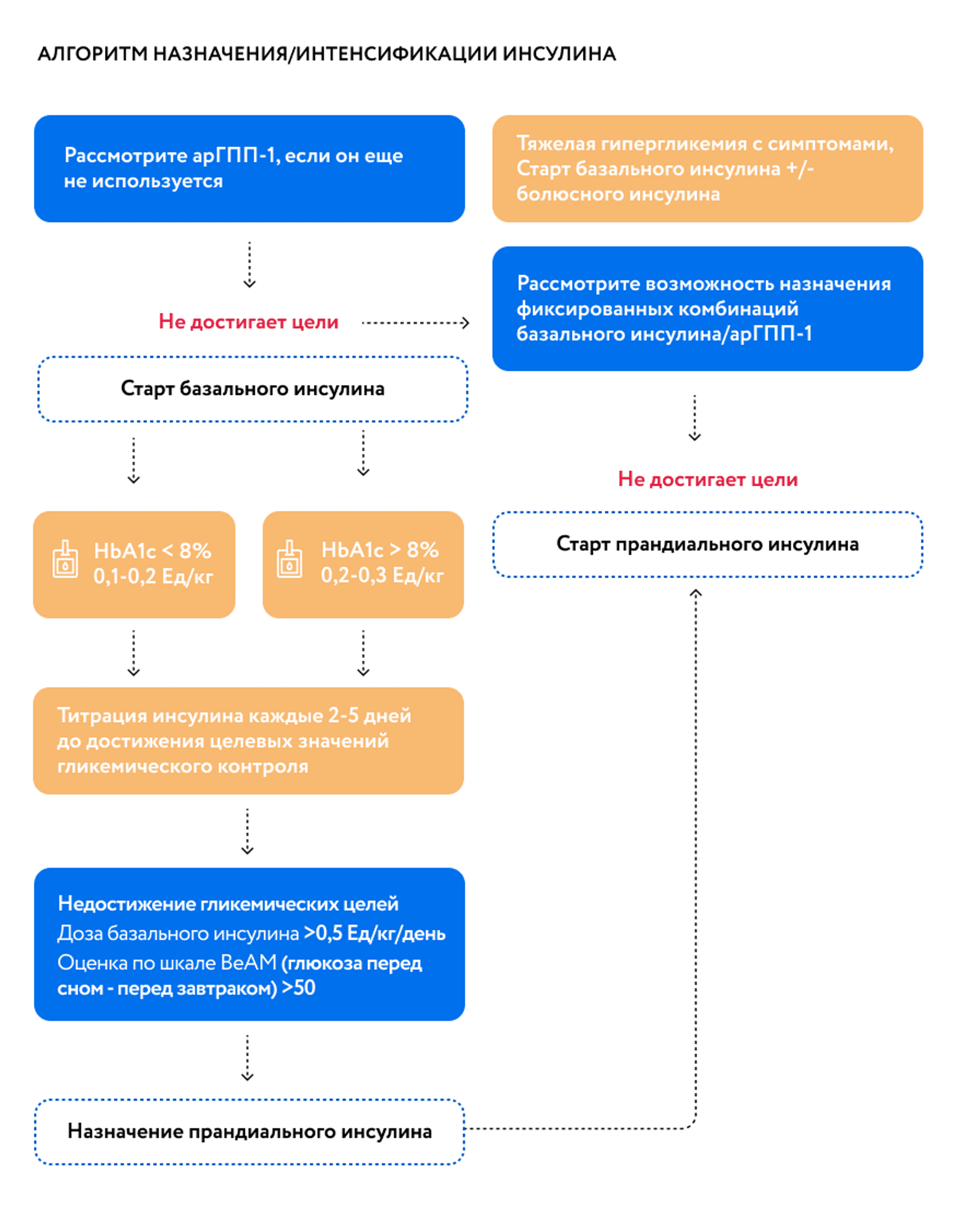
*Адаптировано из AACE Consensus Statement: Comprehensive Type 2 Diabetes Management-2023.
В клинических исследованиях фиксированные комбинации арГПП-1 и базального инсулина (инсулин гларгин 100 ед\мл и ликсисенатид, инсулин деглудек 100 Ед\мл и лираглутид) продемонстрировали сходный сахароснижающий эффект с интенсивными режимами инсулинотерапии: базис-болюсной инсулинотерапией и смешанными инсулинами. Такая комбинация сопровождалась более низким риском гипогликемий 1 и 2 уровня по сравнению с интенсивными режимами, что приводит к болееэффективной титрации дозы препарата1, 2. Не было продемонстрировано увеличения массы тела в отличие от терапии смешанными инсулинами или базис-болюсной инсулинотерапии. Введение двух компонентов в одной инъекции повышает удобство для пациентов, что приводит к улучшению восприятия терапии и повышению приверженности к фиксированной комбинации арГПП-1 и базального инсулина по сравнению со сложными режимами. Также особое внимание уделялось метрикам оценки гликемического профиля пациентов. Помимо HbA1c, существуют различные способы использования данных об уровне глюкозы в крови для принятия решений по лечению СД и во время клинических испытаний.
- Амбулаторный профиль глюкозы с НМГ – среднее значение профилей НМГ для построения кривой, которая может помочь в выявлении тенденций и визуальном представлении гликемических паттернов за период мониторирования.
- Самоконтроль глюкозы по 7 точкам позволяет оценить гликемию натощак, перед приемом пищи и после приема пищи.
- Расчетное время нахождения в целевом диапазоне (dTIR) – это доля измерений в рамках самоконтроля уровня глюкозы в крови в пределах установленного для данного пациента целевого диапазона значений. Изменение расчетного TIR может быть предиктором сердечно-сосудистых, микросудистых осложнений и тяжелой гипогликемии у пациентов с СД 2-го типа. Данные расчетного dTIR полезны, когда измерения времени в целевом диапазоне с помощью НМГ недоступны. Поскольку dTIR рассчитывается на основе самоконтроля уровня глюкозы в крови в определенные моменты времени в течение 24-часового периода, ночные значения часто могут быть недоступны. В исследовании FLAT-SUGAR при сравнении данных НМГ у пациентов на свободной комбинации арГПП-1 и базального инсулина с базис-болюсной инсулинотерапией было показано, что использование инретиномиметика значимо превосходило ББИТ по влиянию на коэффициент вариации за 26 недель терапии. Системы НМГ до сих пор остаются не всегда доступной опцией для пациентов с СД 2 типа. Альтернативой данному методу является использование расчетного времени в целевом диапазоне, которое оценивается на основании структурированного самоконтроля гликемии по глюкометру. В исследовании DUAL I было показано, что расчетные показатели времени в диапазонах сильно коррелируют с показателями времени в диапазонах по данным НМГ.
В финале своего доклада профессор Галстян продемонстрировал результаты объединенного анализа данных программы клинических исследований LixiLan. Согласно полученным данным применение фиксированной комбинации арГПП-1 -ликсисенатида и базального инсулина гларгин было ассоциировано с более выраженным увеличением dTIR и уменьшением времени нахождения выше целевого диапазона (dTAR) без увеличения эпизодов гипогликемии (dTBR).
17 ноября 2022 г. впервые в истории диабетологии FDA зарегистрирован препарат – теплизумаб, препятствующий опосредованному Т-клетками аутоиммунному разрушению β -клеток поджелудочной железы. Это первая болезнь-модифицирующая терапия для предотвращения прогрессирования СД 1-го типа. Препарат вводят внутривенно капельно один раз в сутки в течение 14 дней подряд. Он показан, чтобы отсрочить начало СД 1-го типа 3-й стадии у взрослых и детей в возрасте 8 лет и старше, у которых в настоящее время есть СД 1-го типа 2-й стадии. В классификации СД 1-го типа, принятой в 2015 г., стадия 1 определяется как наличие двух или более аутоантител, патогномоничных для СД 1-го типа, с нормогликемией, стадия 2 — наличие аутоантител с бессимптомной дисгликемией, а стадия 3 — манифестация СД 1-го типа с выраженной клинической симптоматикой. По результатам проведенных клинических испытаний, теплизумаб продлил период без СД 1-го типа на 2 года. Среднее время от рандомизации до постановки диагноза СД 1-го типа на 3-й стадии составило 50 месяцев для пациентов, получавших теплизумаб, и 25 месяцев для тех, кто получал плацебо. Это представляет собой статистически значимую задержку в развитии СД 1-го типа на 3-й стадии4.
В мае 2022 г. FDA одобрило тирзепатид – первый двойной агонист рецепторов глюкагоноподобного пептида и глюкозозависимого инсулинотропного полипептида. Препарат не только эффективно нормализует гликемию, но также способствует снижению массы тела. Тирзепатид рекомендован для улучшения контроля уровня глюкозы в крови у взрослых с СД 2-го типа в качестве дополнения к диете и физическим упражнениям5. Результаты исследований продемонстрировали, что 87–92% пациентов достигли HbA1c менее 7,0 %, не менее одной трети пациентов достигли нормогликемии (HbA1c менее 5,7 %) без риска гипогликемии по сравнению с плацебо. При этом, 13–27% участников снизили массу тела ≥15% (до 10–12 кг).
Новый инновационный препарат для лечения дислипидемии был зарегистрирован в России в апреле 2022 г. Инклисиран (Сибрава) – первый и единственный в классе гиполипидемических препаратов на основе малой интерферирующей РНК (миРНК), которая блокирует синтез комплекс PCSK9 внутри клетки. Высокая активность комплекса PCSK9 ассоциирована с разрушением рецепторов ЛПНП, способствуя их повышению в крови. Терапия инклисираном снижает уровень ЛПНП на 52–55%, а комбинированную конечную точку MACE — на 25%. Удобство дозирования препарата (вводится 2 раза в год) повышает приверженность пациентов к лечению.
В марте 2023 г. в России был зарегистрирован финеренон (Фириалта) для лечения ХБП у пациентов с СД 2-го типа. Препарат представляет собой селективный нестероидный антагонист минералокортикоидных рецепторов. Благодаря своему воздействию, финеренон снижает риски неблагоприятных почечных и сердечно-сосудистых исходов, опосредованных процессами воспаления и фиброза. По данным исследований, финеренон замедлял темпы прогрессирования ХБП и снижал риск почечных событий на 23%, сердечно-сосудистых осложнений и смерти от сердечно-сосудистых причин на 14%.
Продолжение одного из главных событий российской эндокринологии читайте во второй части нашего обзора.
Мы получили Вашу заявку и свяжемся с Вами в ближайшее время для подтверждения регистрации
Укажите адрес почты, использованный при регистрации. Мы отправим вам письмо, которое позволит изменить пароль
Нажимая кнопку «Присоединиться», вы подтверждаете свое согласие на обработку компанией Санофи предоставленных вами в форме персональных данных.
Компания Санофи обязуется соблюдать конфиденциальность отправленных вами сообщений. Адрес электронной почты и иная информация, указанная вами в форме, будет использована исключительно для направления ответа на ваше сообщение.
Компания Санофи не будет использовать указанные вами контактные данные для рассылки не запрашиваемых материалов и информации.
Мы получили Вашу заявку и свяжемся с Вами в ближайшее время для подтверждения регистрации
Обращаем Ваше внимание на то, что процесс регистрации не был завершен! Для завершения регистрации Вам необходимо подписать согласие на обработку персональных данных. После этого Вам будут доступны все ресурсы нашего сайта.

Подтвердите свои данные для возобновления доступа. Для этого введите код, отправленный на указанный контакт, и подтвердите сведения о себе.

Вы покидаете ресурс Санофи и переходите на сторонний сайт.
Компания Санофи не несет ответственности за содержание материалов,
размещенных на стороннем ресурсе.
Ссылка:
Подтвердите переход нажатием на кнопку «Перейти» или «Отменить»
