
Обсуждаем, как начать применять данные клинических исследований в своей практике.
Вы нашли статью с результатами сравнительного исследования по интересующей вас теме. Прочитав реферат, поняли, что авторы получили прекрасные результаты, а применение их методов может принести пользу вашим пациентам. Теперь нужно вчитаться, сделать анализ и выводы из этой работы. Чтобы ничего не упустить и понять, как вы можете добиться похожих результатов в своей практике, можно подойти к этой задаче в три шага.

Шаг 1
Обзор дизайна
С чем сравнивается лечение?
Чтобы доказать преимущества нового препарата или лечебного подхода, исследователи должны решить, с чем его сравнивать. Пациенты, получающие исследуемый препарат, называются группой вмешательства (intervention group). Результаты их лечения сравнивают с контрольной группой (control group), в которой пациенты могут принимать плацебо, препарат сравнения или утвержденный стандарт терапии. Выбор метода лечения в контрольной группе зависит от целей исследования и особенностей заболевания. При состояниях, когда терапия является жизненно необходимой, сравнение проводят с установленным стандартом терапии. При функциональном заболевании полезно бывает оценить эффект плацебо1. Например, в исследовании препарата рифаксимин у пациентов с синдромом раздраженного кишечника (СРК), 41 % сообщили об улучшении результатов. И тут можно сказать, что это отличный эффект и такой препарат необходим при этом заболевании. Но в группе плацебо симптомы уменьшились у 31 % участников, что заставляет по-другому взглянуть на результат2.
Как были распределены пациенты по группам?
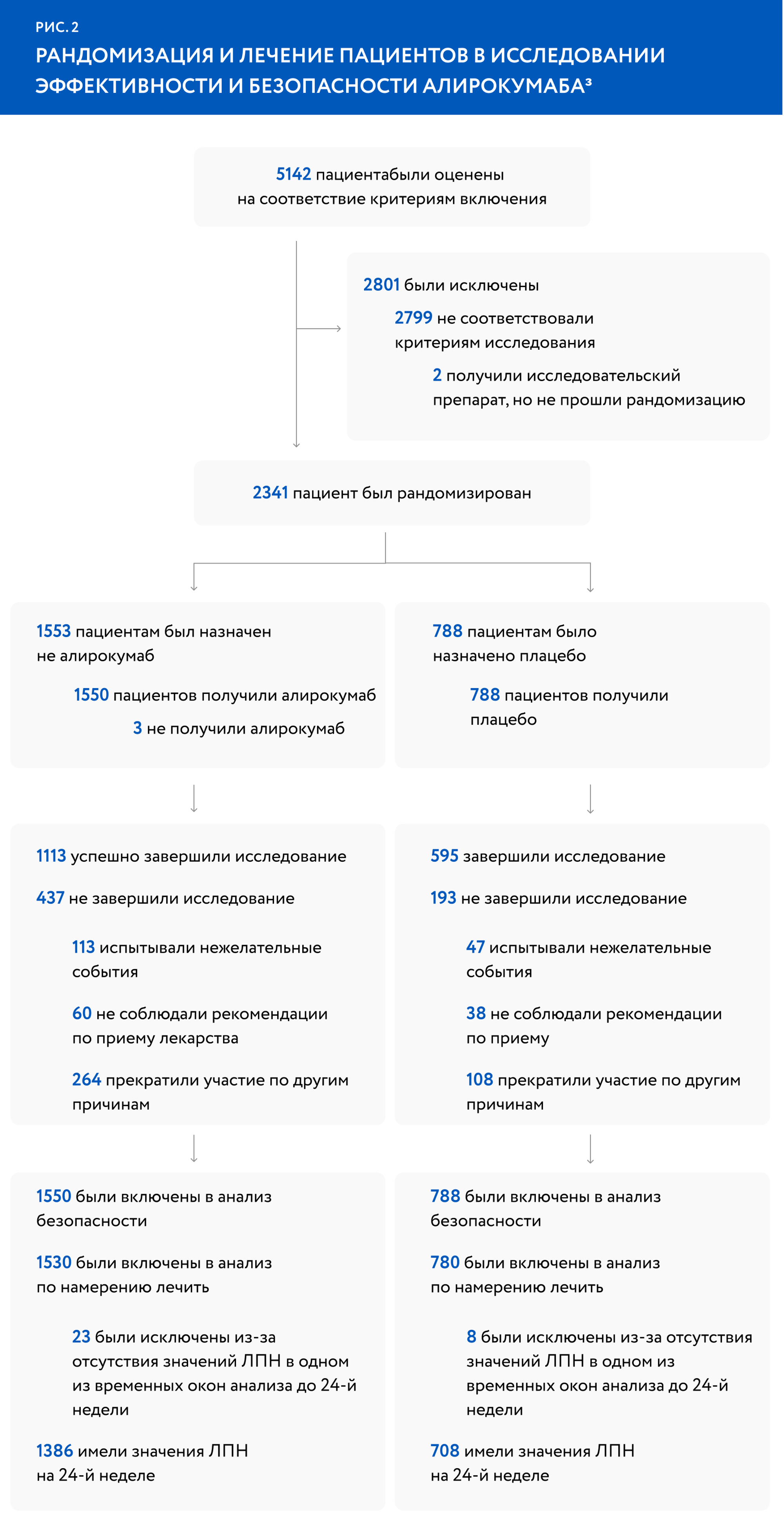
Одним из первых вопросов, который должен решить исследователь — каким способом распределить участников исследования по группам. Если в контрольной группе окажется больше молодых пациентов, которые не имеют сопутствующих заболеваний, это может исказить результат, снизить показатели эффективности изучаемой терапии, несмотря на ее преимущества. Именно поэтому важна рандомизация, то есть случайный отбор пациентов в сравниваемые группы с обеспечением для каждого исследуемого равных шансов попасть в группу вмешательства или контрольную группу. Рандомизация позволяет обеспечить случайность распределения и избежать систематической ошибки, связанной с исходными различиями сравниваемых групп по клинико-демографическим показателям. Существует несколько методов рандомизации, выбор зависит от количества участников. Если это крупное исследование с несколькими тысячами участников, то случайное распределение по группам — наиболее эффективный метод. Если участников меньше 200, то необходимо выравнивать группы по половому и возрастному составу, сопутствующим заболеваниям, расе и т. д.4 Такой подход называется минимизацией. Распределение по группам удобно смотреть на диаграмме CONSORT (Consolidated Standards of Reporting Trials) (рис. 2), которая обычно является первой схемой в клиническом исследовании и отражает предусмотренную дизайном исследования маршрутизацию потока пациентов.
Для примера можно рассмотреть рандомизацию пациентов на терапию алирокумабом и плацебо в исследовании ODYSSEY (рис. 2). Мы видим, что в исследовании принял участие 2341 пациент. Из них 1553 получали алирокумаб, а 788 — плацебо.
Сопоставимы ли группы?
Рандомизация должна была поделить пациентов на группы случайным образом, чтобы у каждой из них был изначально одинаковый шанс на успех в лечении. Насколько хорошо это было сделано, можно увидеть в таблице с результатами сравнения пациентов по исходным клинико-демографическим данным (demographic and baseline characteristics).
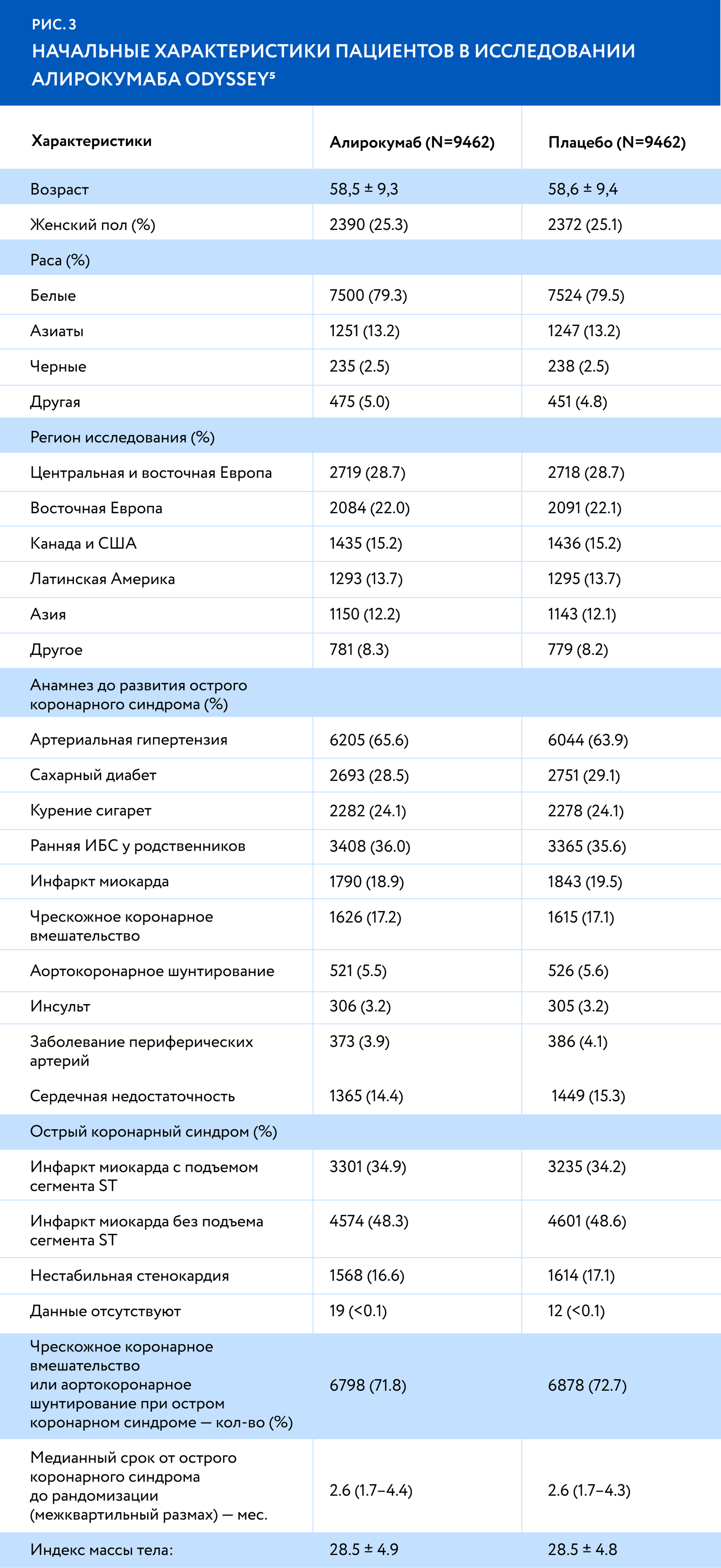
В таблице мы видим, что группы плацебо и терапии схожи по ключевым показателям5: одинаковый средний возраст, половой состав и частота сопутствующих заболеваний.
Если вы увидите, что баланс отсутствует, то попробуйте проанализировать, насколько разница в начальных характеристиках пациентов повлияла на полученные результаты.
Знают ли участники, в какой они группе?
Чтобы непредвзято оценить эффективность экспериментального лечения, ни участник исследования, ни исследователь не должны знать о результатах рандомизации. Если получающий плацебо пациент знает, что желтая таблетка — всего лишь пустышка, это может привести к психосоматическому эффекту и вызвать ухудшение состояния. В другой ситуации врач, зная, что пациент попал в группу вмешательства и получает новый препарат, может усилить внимание к этому пациенту, невольно влияя на результаты лечения. Таким образом, информированность участников исследования о том, в какой группе находится пациент, способна создать искажения, которые могут дискредитировать результаты. Чтобы исключить человеческий фактор, применяют «ослепление». Если о том, какой препарат принимает, не знает только пациент, это называется простым слепым исследованием (single blind). Более достоверны результаты двойных слепых исследований, когда о распределении по группам не знают ни пациент, ни врач (double blind). Иногда исследователи идут еще дальше, и о распределении по группам не знает и статистик, обрабатывающий данные — в этом случае исследование называют тройным слепым (triple blind)6. Двойное слепое исследование считается золотым стандартом. Однако реализовать его не всегда получается, например когда речь идет о хирургическом лечении или назначении препаратов с уникальным способом доставки действующего вещества (внутриглазные имплантаты, инфузионные помпы и т. д.).
Проводилось ли сопутствующее вмешательство?
Иногда из-за особенностей заболевания дизайн предусматривает дополнительное лечение, которое не относится к изучаемой терапии. Например, при изучении лекарственной противораковой терапии у пациента произошло метастазирование, из-за чего потребовалась лучевая терапия. Хоть это вмешательство и необходимо, оно может повлиять на результаты исследования. Для большей объективности и меньшего искажения результатов важно, чтобы в обеих группах такие случаи происходили с одинаковой частотой1.
Насколько высока была приверженность пациентов лечению?
Соблюдение участниками исследования назначенного им лечения называется приверженностью (adherence). О ней можно судить по диаграмме CONSORT. Пациенты выбывают из исследований по многим причинам, но две из них наиболее важны: нежелательные явления, к которым относятся побочные эффекты, и отсутствие ощутимой пользы от терапии. Если в группе вмешательства участники часто выбывают по причинам, не связанным с нежелательными явлениями, это может насторожить вас с точки зрения реальной пользы лечения для пациента2.
Все ли пациенты, принявшие участие в исследовании, были учтены в анализе?
Исследование завершилось, ряд пациентов не начали лечение, другие прервали его из-за нежелательных эффектов, потери интереса или по иным причинам. Нужно ли учитывать их результаты в финальном анализе, если они не получили полного курса препарата?
Здесь есть два подхода. Первый называется анализ по протоколу (per-protocol analysis). В нем сравнивают пациентов, которые получили лечение или завершили весь курс. Второй подход включает в анализ всех пациентов, которые прошли рандомизацию. То есть, даже если пациент не получил ни одной дозы препарата, его результаты будут учтены. Это называется анализом по намерению лечить (ITT, intention-to-treat analysis).
На первый взгляд он может показаться менее правильным, но только так можно избежать систематической ошибки и сохранить начальные шансы пациентов всех групп на успех терапии, которые были выровнены на этапе рандомизации.
Пример. Хирурги решили доказать, что оперативное лечение снижает риск смерти у пациентов с сердечно-сосудистыми заболеваниями. В исследовании участвовали 200 пациентов, которых рандомизировали 1:1. Между рандомизацией и операцией прошло в среднем шесть недель. Через год врачи получили результаты. В группе хирургического лечения умерли 30 пациентов: 15 до операции и 15 после операции. В контрольной группе летальный исход также у 30 пациентов: 15 в первые 6 недель после рандомизации и 15 за оставшуюся часть года. Если проводить анализ по протоколу, то можно сделать вывод, что смертность в группе оперативного лечения составляет 15 из 85 или 18 %, при этом в группе сравнения умерли 30 из 100 или 30 %. Напрашивается ложный вывод, что операция почти в два раза повышает выживаемость. Однако пациенты продолжали умирать, несмотря на хирургическое лечение. При анализе по намерению лечить (ITT) риск смерти в обеих группах будет одинаковым — 30 %7.

Как оценить результаты клинического исследования, читайте в шаге 2, а применимость в практике описана в шаге 3.
Мы получили Вашу заявку и свяжемся с Вами в ближайшее время для подтверждения регистрации
Укажите адрес почты, использованный при регистрации. Мы отправим вам письмо, которое позволит изменить пароль
Нажимая кнопку «Присоединиться», вы подтверждаете свое согласие на обработку компанией Санофи предоставленных вами в форме персональных данных.
Компания Санофи обязуется соблюдать конфиденциальность отправленных вами сообщений. Адрес электронной почты и иная информация, указанная вами в форме, будет использована исключительно для направления ответа на ваше сообщение.
Компания Санофи не будет использовать указанные вами контактные данные для рассылки не запрашиваемых материалов и информации.
Мы получили Вашу заявку и свяжемся с Вами в ближайшее время для подтверждения регистрации
Обращаем Ваше внимание на то, что процесс регистрации не был завершен! Для завершения регистрации Вам необходимо подписать согласие на обработку персональных данных. После этого Вам будут доступны все ресурсы нашего сайта.

Подтвердите свои данные для возобновления доступа. Для этого введите код, отправленный на указанный контакт, и подтвердите сведения о себе.

Вы покидаете ресурс Санофи и переходите на сторонний сайт.
Компания Санофи не несет ответственности за содержание материалов,
размещенных на стороннем ресурсе.
Ссылка:
Подтвердите переход нажатием на кнопку «Перейти» или «Отменить»
