Регистрационный номер: ЛП-№(000323)-(РГ-RU)-270721.
Торговое наименование препарата: Соликва СолоСтар®. Международное непатентованное или группировочное наименование: инсулин гларгин + ликсисенатид.
Лекарственная форма: раствор для подкожного введения.
Данный лекарственный препарат подлежит дополнительному мониторингу. Это позволит быстро выявить новую информацию о безопасности. Мы обращаемся к работникам системы здравоохранению с просьбой сообщать о любых подозреваемых нежелательных реакциях.
Порядок сообщения о нежелательных реакциях представлен в разделе «Клинические данные. Нежелательные реакции».
Соликва СолоСтар®, 100 ЕД/мл + 50 мкг/мл, раствор для подкожного введения.
Соликва СолоСтар®, 100 ЕД/мл + 33 мкг/мл, раствор для подкожного введения.
Действующие вещества: инсулин гларгин*, ликсисенатид.
Соликва СолоСтар®, 100 ЕД/мл + 50 мкг/мл, раствор для подкожного введения
Каждая предварительно заполненная шприц-ручка содержит 300 ЕД инсулина гларгин и 150 мкг ликсисенатида в 3 мл раствора.
В каждом мл содержится 100 ЕД инсулина гларгин и 50 мкг ликсисенатида.
Соликва СолоСтар®, 100 ЕД/мл + 33 мкг/мл, раствор для подкожного введения
Каждая предварительно заполненная шприц-ручка содержит 300 ЕД инсулина гларгин и 100 мкг ликсисенатида в 3 мл раствора.
В каждом мл содержится 100 ЕД инсулина гларгин и 33 мкг ликсисенатида.
*Получено с использованием Escherichia coli по технологии рекомбинантной ДНК. Вспомогательные вещества, наличие которых надо учитывать в составе лекарственного препарата: каждый мл раствора содержит 2,7 мг метакрезола (см. разделы 4.4).
Полный перечень вспомогательных веществ приведен в разделе 6.1.
Раствор для подкожного введения.
Прозрачный, бесцветный или почти бесцветный раствор в предварительно заполненной шприц-ручке.
4.1 Клинические данные. Показания к применению
У взрослых пациентов с недостаточно контролируемым сахарным диабетом 2 типа с целью улучшения гликемического контроля в качестве дополнения к диете и повышенной физической нагрузке в комбинации с метформином в сочетании или без сочетания с ингибиторами НГЛТ2 (натрий-глюкозных ко-транспортеров 2 типа).
4.2 Клинические данные. Режим дозирования и способ применения
Для удобства индивидуального подбора дозы препарат Соликва СолоСтар® выпускается в двух шприц-ручках, предоставляющих выбор различных доз.
Различия между этими двумя шприц-ручками заключаются в диапазоне доз действующих веществ в шприц-ручках (см. ниже).
• Соликва СолоСтар® 100 EД/мл и 50 мкг/мл: шприц-ручка 10-40
- 1 единица препарата в этой шприц-ручке Соликва СолоСтар® содержит 1 ЕД инсулина гларгин и 0,5 мкг ликсисенатида.
- Эта шприц-ручка дает возможность получения суточной дозы от 10 до 40 единиц препарата Соликва СолоСтар® (от 10 до 40 ЕД инсулина гларгин в комбинации с ликсисенатидом в дозе от 5 мкг до 20 мкг).
• Соликва СолоСтар® 100 ЕД/мл и 33 мкг/мл: шприц-ручка 30-60
- 1 единица препарата в этой шприц-ручке Соликва СолоСтар® содержит 1 ЕД инсулина гларгин и 0,33 мкг ликсисенатида.
- Эта шприц-ручка дает возможность получения суточной дозы от 30 до 60 единиц препарата Соликва СолоСтар® (от 30 до 60 ЕД инсулина гларгин в комбинации с ликсисенатидом в дозе от 10 мкг до 20 мкг).
Во избежание ошибочного введения препарата лечащий врач должен правильно указать в рецепте вид шприц-ручки и количество единиц препарата (см. раздел 4.4).
Режим дозирования
Доза препарата Соликва СолоСтар® должна подбираться индивидуально на основании клинического ответа и титроваться, исходя из потребности пациента в инсулине. Доза ликсисенатида увеличивается или уменьшается вместе с дозой инсулина гларгин, а также зависит от того, какая из вышеуказанных шприц-ручек используется.
Коррекцию дозы или изменение времени введения препарата Соликва СолоСтар® следует проводить только под врачебным наблюдением с соответствующим мониторингом концентрации глюкозы в крови (см. раздел 4.4).
Начальная доза препарата Соликва СолоСтар®
Перед началом терапии препаратом Соликва СолоСтар® следует прекратить терапию любым другим базальным инсулином, агонистами рецепторов глюкагоноподобного пептида-1 (ГПП1), пероральными гипогликемическими средствами (кроме метформина и ингибиторов натрий-глюкозных ко-транспортеров 2 типа (НГЛТ2)).
Начальная доза препарата Соликва СолоСтар® выбирается, исходя из предшествующего лечения гипогликемическими препаратами, и не должна превышать начальную дозу ликсисенатида 10 мкг.
Начальная доза препарата Соликва СолоСтар®
| Предшествующее лечение | ||||
|---|---|---|---|---|
| Пероральные гипогликеми-ческие препараты или агонисты ГПП1 (пациенты, не получавшие инсулина) | Инсулин гларгин (100 ЕД/мл)** ≥20 ЕД - <30 ЕД | Инсулин гларгин (100 ЕД/мл)** ≥30 ЕД- ≤60 ЕД | ||
| Начальная доза и тип шприц-ручки | Шприц-ручка Соликва СолоСтар® (10-40) | 10 единиц препарата (10 ЕД/5 мкг)* | 20 единиц препарата (20 ЕД/10 мкг)* | |
| Шприц-ручка Соликва СолоСтар® (30-60) | 30 единиц препарата (30 ЕД/10 мкг)* | |||
* единиц инсулина гларгин (100 ЕД/мл)/мкг ликсисенатида
** Если использовался другой базальный инсулин:
• Для базального инсулина (вводимого 2 раза в сутки) или инсулина гларгин 300 ЕД/мл (вводимого 1 раз в сутки), общую суточную дозу необходимо сначала уменьшить на 20 %, а затем выбрать стартовую дозу препарата Соликва СолоСтар®.
• Для любого другого базального инсулина следует применять то же правило, что и для инсулина гларгин (100 ЕД/мл).
Максимальная суточная доза препарата Соликва СолоСтар® составляет 60 единиц (60 ЕД инсулина гларгин и 20 мкг ликсисенатида).
Препарат Соликва СолоСтар® вводится подкожно 1 раз в сутки в течение 1 ч перед любым приемом пищи. Предпочтительно, чтобы прандиальная (перед приемом пищи) инъекция препарата Соликва СолоСтар® проводилась ежедневно перед одним и тем же приемом пищи, выбранным, как наиболее подходящий для пациента. В случае пропуска введения дозы препарата Соликва СолоСтар®, ее следует ввести в течение 1 ч перед следующим приемом пищи.
Титрование дозы препарата Соликва СолоСтар®
Препарат Соликва СолоСтар® должен дозироваться в соответствии с индивидуальной потребностью пациента в инсулине. С целью улучшения гликемического контроля рекомендуется корректировать дозу препарата на основании определения концентрации глюкозы в плазме крови натощак.
При переходе на терапию препаратом Соликва СолоСтар® и в последующие недели рекомендуется проведение тщательного мониторинга концентрации глюкозы в крови.
• Если лечение пациента начинается с использования шприц-ручки Соликва СолоСтар® (10-40), то с помощью этой шприц-ручки доза может титроваться до 40 единиц препарата.
• При общих суточных дозах > 40 единиц препарата/сутки следует перейти на использование шприц-ручки Соликва СолоСтар® (30-60).
• Если лечение пациента начинается с использования шприц-ручки Соликва СолоСтар® (30-60), то с помощью этой шприц-ручки доза может титроваться до 60 единиц препарата.
• При общих суточных дозах > 60 единиц препарата/сутки нельзя использовать препарат Соликва СолоСтар®.
Особые группы пациентов
Пациенты в возрасте ≥ 65 лет
Препарат Соликва СолоСтар® можно применять у пациентов в возрасте ≥ 65 лет. Доза должна корректироваться индивидуально, исходя из мониторинга концентраций глюкозы в крови. Опыт применения препарата у пациентов в возрасте ≥ 75 лет ограничен.
Пациенты с нарушением функции почек
Препарат Соликва СолоСтар® не рекомендуется пациентам с почечной недостаточностью тяжелой степени и терминальной стадией почечной недостаточности, поскольку отсутствует терапевтический опыт применения ликсисенатида в данной группе пациентов.
У пациентов с почечной недостаточностью средней и легкой степени тяжести коррекция дозы ликсисенатида не требуется. У пациентов с почечной недостаточностью потребность в инсулине может быть снижена из-за сниженного метаболизма инсулина.
У пациентов с почечной недостаточностью средней и легкой степени тяжести при применении препарата Соликва СолоСтар® требуется мониторинг концентрации глюкозы в крови и может потребоваться коррекция дозы.
Пациенты с нарушением функции печени
Влияние печеночной недостаточности на фармакокинетику препарата Соликва СолоСтар® не изучалось.
Коррекции дозы ликсисенатида у пациентов с печеночной недостаточностью не требуется (см. раздел 5.2). У пациентов с печеночной недостаточностью потребность в инсулине может уменьшаться вследствие снижения способности к глюконеогенезу и замедления метаболизма инсулина. У пациентов с печеночной недостаточностью может потребоваться частый мониторинг концентрации глюкозы в крови и коррекция дозы препарата Соликва СолоСтар®.
Дети и подростки до 18 лет
Безопасность и эффективность препарата Соликва СолоСтар® у детей и подростков младше 18 лет не установлена.
Способ применения
Препарат Соликва СолоСтар® нельзя вводить внутривенно и внутримышечно.
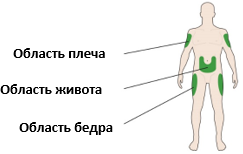
Препарат Соликва СолоСтар® вводится подкожно в область живота, плеча или бедра.
Места инъекций следует чередовать в пределах одной области (живот, плечо или бедро) от одной инъекции к следующей, чтобы снизить риск липодистрофии и локализованного кожного амилоидоза (см. разделы 4.4 и 4.8). Нельзя вводить препарат в области липодистрофии и кожного амилоидоза.
Пациенты должны всегда использовать новую иглу, так как при повторном использовании игл инсулиновой шприц-ручки увеличивается риск закупорки иглы, что может привести к передозировке или недостаточной дозировке. В случае закупорки игл пациенты должны следовать инструкциям, описанным в «Инструкции по использованию шприц-ручки Соликва СолоСтар®», прилагаемой к упаковке (см. раздел 6.6).
Препарат Соликва СолоСтар® нельзя набирать из картриджа предварительно заполненной шприц-ручки в шприц, чтобы избежать ошибок дозирования и потенциальной передозировки (см. раздел 4.4).
Подробный способ применения лекарственного препарата см. раздел 6.6.
4.3 Клинические данные. Противопоказания
• Гиперчувствительность к инсулину гларгин, ликсисенатиду, или к любому из вспомогательных веществ, перечисленных в разделе 6.1.
• Сахарный диабет 1 типа.
• Диабетический кетоацидоз.
• Тяжелые заболевания желудочно-кишечного тракта (ЖКТ), включая гастропарез.
• Почечная недостаточность тяжелой степени (КК менее 30 мл/мин).
4.4 Клинические данные. Особые указания и меры предосторожности при применении
С осторожностью следует назначать препарат при панкреатите в анамнезе (из-за содержания в составе препарата ликсисенатида), у пациентов, одновременно принимающих препараты, требующие быстрой абсорбции из ЖКТ, имеющие узкий терапевтический индекс или нуждающиеся в тщательном клиническом мониторинге.
Гипогликемия
Гипогликемия является наиболее частой нежелательной реакцией во время лечения препаратом Соликва СолоСтар®. Гипогликемия возникает, если доза препарата Соликва СолоСтар® выше, чем потребность в нем.
Факторы, повышающие предрасположенность к гипогликемии, требуют тщательного мониторинга и могут потребовать коррекцию режима дозирования. К этим факторам относятся:
- изменение места инъекции;
- повышение чувствительности к инсулину (например, из-за прекращения действия стрессовых факторов);
- непривычные, более тяжелые или более длительные физические нагрузки;
- сопутствующие заболевания (например, рвота, диарея);
- недостаточное потребление пищи;
- пропуск приема пищи;
- употребление алкоголя (этанола);
- некоторые некомпенсированные эндокринные нарушения (такие как гипотиреоз и недостаточность гормонов передней доли гипофиза или коры надпочечников);
- сопутствующая терапия некоторыми лекарственными препаратами (см. раздел 4.5).
При одновременном применении ликсисенатида и/или инсулина с производными сульфонилмочевины повышен риск развития гипогликемии, в связи с чем, препарат Соликва СолоСтар® не следует применять в сочетании с препаратами сульфонилмочевины.
Доза препарата Соликва СолоСтар® должна подбираться индивидуально по клиническому эффекту и титроваться, исходя из потребности пациента в инсулине (см. раздел 4.2).
Гипергликемия
Гипергликемия может развиться у пациентов, если доза препарата Соликва СолоСтар® ниже, чем потребность в нем.
К факторам развития гипергликемии относятся:
• • пропуск введения дозы препарата Соликва СолоСтар® или введение недостаточной дозы;
• • нарушение правил хранения препарата;
• • нарушение работы шприц-ручки;
• • стресс, эмоциональные расстройства;
• • инфекционные заболевания, повышенная температура тела;
• • недавно перенесенные оперативные вмешательства;
• • одновременный прием препаратов, снижающих гипогликемическое действие инсулина (см. раздел 4.5).
Основными симптомами гипергликемии являются жажда, учащенное мочеиспускание, усталость, сухость кожи, покраснение лица, потеря аппетита, снижение артериального давления, учащенное сердцебиение, глюкозурия, кетонурия. При развитии гипергликемии возрастает риск развития диабетического кетоацидоза.
Пациент должен быть информирован о том, что при развитии симптомов и признаков гипергликемии следует немедленно обратиться к врачу для проведения обследования и получения необходимой медицинской помощи.
Липодистрофия и локализованный кожный амилоидоз
Пациенты должны быть проинструктированы о постоянном изменении места инъекции, чтобы снизить риск развития липодистрофии и локализованного кожного амилоидоза. Существует потенциальный риск депонирования и снижения абсорбции инсулина и ухудшения гликемического контроля после инъекций инсулина в места с данными реакциями. Сообщалось, что внезапное изменение места инъекции на непораженную область приводит к развитию гипогликемии. После смены места инъекции рекомендуется мониторинг концентрации глюкозы в крови и коррекция дозы, кроме того, может потребоваться изменение дозы гипогликемических препаратов.
Острый панкреатит
Применение агонистов рецепторов ГПП1 связано с риском развития острого панкреатита. Зарегистрировано несколько случаев острого панкреатита при применении ликсисенатида, хотя не было установлено причинно-следственной взаимосвязи между ними. Пациенты должны быть проинформированы о характерных симптомах панкреатита: длительно сохраняющиеся (персистирующие) сильные боли в животе. При подозрении на панкреатит применение препарата Соликва СолоСтар® следует прекратить. При подтверждении диагноза острого панкреатита не следует возобновлять лечение препаратом Соликва СолоСтар®. Препарат Соликва СолоСтар® следует применять с осторожностью у пациентов с панкреатитом в анамнезе.
Применение у пациентов с тяжелыми заболеваниями ЖКТ
Применение агонистов рецепторов ГПП1 может быть связано с развитием нежелательных реакций со стороны ЖКТ. Препарат Соликва СолоСтар® не изучался у пациентов с тяжелыми заболеваниями ЖКТ, включая тяжелый гастропарез, и поэтому применение препарата Соликва СолоСтар® у данных пациентов противопоказано.
Почечная недостаточность тяжелой степени
Отсутствует терапевтический опыт применения препарата у пациентов с почечной недостаточностью тяжелой степени (КК менее 30 мл/мин) или с терминальной стадией почечной недостаточности. Применение препарата противопоказано у пациентов с почечной недостаточностью тяжелой степени (КК менее 30 мл/мин) или терминальной почечной недостаточностью (см. раздел 4.2 и 5.2).
Одновременное применение лекарственных препаратов
Замедление опорожнения желудка при применении ликсисенатида может замедлять скорость абсорбции лекарственных препаратов, принимаемых внутрь. Препарат Соликва СолоСтар® следует применять с осторожностью у пациентов, принимающих внутрь лекарственные препараты, которые быстро всасываются в ЖКТ, требуют тщательного клинического контроля или имеют узкий терапевтический индекс (см. раздел 4.5).
Дегидратация
Пациентов, получающих лечение препаратом Соликва СолоСтар®, следует информировать о потенциальном риске дегидратации в связи с развитием нежелательных реакций со стороны ЖКТ и о соблюдении мер предосторожности во избежание потери жидкости.
Образование антител
Применение препарата Соликва СолоСтар® может вызывать образование антител к инсулину гларгин и/или ликсисенатиду. В редких случаях при наличии таких антител может потребоваться коррекция дозы препарата Соликва СолоСтар® с целью коррекции тенденции к развитию гипер- или гипогликемии.
Предотвращение ошибок при введении препарата
Пациенты должны быть проинструктированы о необходимости всегда проверять этикетку шприц-ручки перед каждым введением препарата, чтобы избежать случайного перепутывания между собой двух шприц-ручек Соликва СолоСтар®, имеющих различные концентрации действующих веществ, или перепутывания с другими шприц-ручками с другими инъекционными противодиабетическими препаратами.
Для того чтобы избежать ошибок дозирования препарата и передозировки, пациенты и медицинские работники никогда не должны использовать шприц для извлечения препарата из картриджа предварительно заполненной шприц-ручки Соликва СолоСтар®.
Дополнительная информация
Не изучалось одновременное применение препарата Соликва СолоСтар® с ингибиторами дипептидилпептидазы IV, производными сульфонилмочевины, глинидами, пиоглитазоном.
Вспомогательные вещества
Препарат Соликва СолоСтар® содержит метакрезол, который может вызывать развитие аллергических реакций.
Препарат Соликва СолоСтар® содержит менее 1 ммоля (23 мг) натрия в одной дозе. Это означает, что он практически не содержит натрий.
4.5 Клинические данные. Взаимодействие с другими лекарственными препаратами и другие виды взаимодействий
Исследования по взаимодействию препарата Соликва СолоСтар® с другими лекарственными средствами не проводились.
Фармакодинамическое взаимодействие
Ряд лекарственных средств влияет на метаболизм глюкозы, вследствие чего при их одновременном применении с инсулином может потребоваться коррекция дозы инсулина и особенно тщательное наблюдение, включая мониторинг концентрации глюкозы в крови.
- Лекарственные средства, которые могут увеличивать гипогликемическое действие инсулина и склонность к развитию гипогликемии: пероральные гипогликемические препараты, ингибиторы ангиотензинпревращающего фермента (АПФ), салицилаты, дизопирамид; фибраты; флуоксетин, ингибиторы моноаминоксидазы (MAO); пентоксифиллин; пропоксифен; противомикробные средства из группы сульфаниламидов.
- Лекарственные средства, которые могут ослаблять гипогликемическое действие инсулина: глюкокортикостероиды, даназол, диазоксид, диуретики, глюкагон, изониазид, эстрогены и прогестагены, производные фенотиазина, соматропин, симпатомиметические лекарственные средства (например, эпинефрин [адреналин], сальбутамол, тербуталин); гормоны щитовидной железы, атипичные антипсихотические лекарственные средства (например, оланзапин и клозапин) и ингибиторы протеаз.
- Бета-адреноблокаторы, клонидин, соли лития и этанол могут, как усиливать, так и ослаблять гипогликемический эффект инсулина.
- Пентамидин может вызывать гипогликемию, после которой в некоторых случаях может развиваться гипергликемия.
Помимо этого, под воздействием симпатолитических лекарственных средств, таких как бета-адреноблокаторы, клонидин, гуанетидин и резерпин, признаки адренергической контррегуляции (активации симпатической нервной системы в ответ на гипогликемию) могут быть менее выражены или отсутствовать.
Фармакокинетическое взаимодействие
Ликсисенатид является пептидом и не метаболизируется с помощью изоферментов системы цитохрома P450. В исследованиях in vitro ликсисенатид не влиял на активность протестированных изоферментов системы цитохрома P450 или транспортеров у человека.
Влияние задержки опорожнения желудка на абсорбцию принимаемых внутрь лекарственных препаратов
Задержка опорожнения желудка при применении ликсисенатида может уменьшить скорость абсорбции лекарственных препаратов, принимаемых внутрь. Следует соблюдать осторожность при одновременном приеме внутрь лекарственных препаратов с узким терапевтическим диапазоном или требующих тщательного клинического мониторинга. Если такие препараты следует принимать во время еды, пациентам следует рекомендовать их прием с тем приемом пищи, когда не вводится ликсисенатид. Лекарственные препараты для приема внутрь, эффективность которых особенно зависит от пороговых концентраций, такие как антибиотики, следует принимать не менее чем за 1 ч до или через 4 ч после инъекции препарата Соликва СолоСтар®.
Гастрорезистентные препараты следует принимать не менее чем за 1 ч до или через 4 ч после инъекции препарата Соликва СолоСтар®.
С парацетамолом
Коррекции дозы парацетамола при одновременном применении с препаратом Соликва СолоСтар® не требуется, однако в случае необходимости быстрого начала действия парацетамола, его следует принимать через 1-4 часа после инъекции препарата Соликва СолоСтар® ввиду возможного увеличения времени достижения максимальной концентрации парацетамола в плазме крови.
С пероральными контрацептивными препаратами
Пациенткам, применяющим пероральные контрацептивные препараты, следует рекомендовать принимать не менее чем за 1 ч до или через 11 ч после инъекции препарата Соликва СолоСтар®.
С аторвастатином
Пациентам, принимающим аторвастатин, следует рекомендовать его прием не менее чем за 1 ч до или через 11 ч после инъекции препарата Соликва СолоСтар®.
Коррекция дозы при совместном применении аторвастатина и препарата Соликва СолоСтар® не требуется.
С варфарином
Коррекции дозы варфарина при его совместном применении с препаратом Соликва СолоСтар® не требуется, однако рекомендуется частый мониторинг международного нормализованного отношения (МНО) в начале и после окончания терапии препаратом Соликва СолоСтар®.
С дигоксином
Коррекции дозы дигоксина при его совместном применении с препаратом Соликва СолоСтар® не требуется.
С рамиприлом
Коррекции дозы рамиприла при его совместном применении с препаратом Соликва СолоСтар® не требуется.
4.6 Фертильность, беременность и лактация
Женщины с детородным потенциалом
Применение препарата Соликва СолоСтар® не рекомендуется женщинам с сохраненным детородным потенциалом, не принимающим контрацептивы.
Беременность
Отсутствуют данные контролируемых клинических исследований по применению в период беременности препарата Соликва СолоСтар®, инсулина гларгин или ликсисенатида.
В исследованиях на животных была продемонстрирована репродуктивная токсичность ликсисенатида (см. раздел 5.3); не выявлено эмбриотоксичности и тератогенности инсулина гларгин.
Потенциальный риск для человека неизвестен. Препарат Соликва СолоСтар® противопоказан при беременности (из-за содержания в составе препарата ликсисенатида).
При планировании беременности или ее наступлении лечение препаратом Соликва СолоСтар® следует прекратить.
Лактация
Нет данных о проникновении в грудное молоко человека инсулина гларгин или ликсисенатида. Применение препарата Соликва СолоСтар® в период грудного вскармливания противопоказано.
Фертильность
Исследования, проведенные на животных с инсулином гларгин и ликсисенатидом, не показали их непосредственного неблагоприятного воздействия на фертильность.
4.7 Клинические данные. Влияние на способность управлять транспортными средствами и работать с механизмами
Препарат Соликва СолоСтар® не оказывает или оказывает незначительное влияние на способность управлять транспортными средствами или работать с механизмами. Однако способность концентрироваться и реагировать может быть нарушена из-за гипогликемии или гипергликемии, или, например, в результате нарушения зрения. Это может представлять опасность в ситуациях, когда эти способности имеют особое значение (например, при управлении транспортными средствами или работе с механизмами).
Пациентам следует рекомендовать соблюдать меры предосторожности, чтобы избежать гипогликемии во время управления транспортными средствами или работы с механизмами. Это особенно важно у тех пациентов, у которых ослаблено или отсутствует распознавание симптомов, предвещающих развитие гипогликемии, или у пациентов с частыми эпизодами гипогликемии. В таких случаях должен быть рассмотрен вопрос о целесообразности управления транспортными средствами или механизмами.
4.8 Клинические данные. Нежелательные реакции
Резюме профиля безопасности
Наиболее частыми нежелательными реакциями во время лечения препаратом Соликва СолоСтар® являлись гипогликемия и нежелательные реакции со стороны желудочно-кишечного тракта (см. подраздел «Описание отдельных нежелательных реакций»).
Табличное резюме нежелательных реакций
Нежелательные реакции, связанные с применением препарата и наблюдавшиеся в ходе клинических исследований, представлены по системно-органным классам в порядке убывания частоты их развития очень часто ( 10 %); часто (≥ 1 %; < 10 %); нечасто (≥ 0,1 %; 1 %); редко (≥ 0,01 %; 0,1%); очень редко ( 0,01 %); частота неизвестна (определить частоту встречаемости нежелательных реакций по имеющимся данным не представляется возможным).
| Системно-органный класс | Частота | |||
|---|---|---|---|---|
| Очень часто | Часто | Нечасто | Частота неизвестна | |
| Инфекции и инвазии | Назофарингит Инфекция верхних дыхательных путей |
|||
| Нарушения со стороны имунной системы: | Крапивница | |||
| Нарушения со стороны метаболизма и питания | Гипогликемия | |||
| Нарушения со стороны нервной системы | Головокружения | Головная боль | ||
| Желудочно-кишечные нарушения | Тошнота Диарея Рвота |
Диспепсия Боль в животе |
||
| Нарушения со стороны кожи и подкожных тканей | Кожный амилоидоз Липодистрофия |
|||
| Общие нарушения и реакции в месте введения | Реакции в месте инъекции | Повышенная утомляемость | ||
Описание отдельных нежелательных реакций
Гипогликемия
В следующей таблице описана частота документально подтвержденных симптоматических гипогликемий (≤ 3,9 ммоль/л) и тяжелой гипогликемии как для препарата Соликва СолоСтар®, так и для препарата сравнения.
Документированные гипогликемические нежелательные реакции, протекающие с клинической симптоматикой, или тяжелые гипогликемические нежелательные реакции
| Пациенты, не получавшие лечения инсулином | Перевод с базального инсулина | Перевод с терапии агонистами рецепторов ГПП1 | |||||
|---|---|---|---|---|---|---|---|
| Соликва СолоСтар® | Инсулин гларгин | Ликсисенатид | Соликва СолоСтар® | Инсулин гларгин | Соликва СолоСтар® | Агонисты рецепторов ГПП1 | |
| Количество пациентов | 469 | 467 | 233 | 365 | 365 | 255 | 256 |
| Документированная протекающая с клинической симптоматикой гипогликемия * | |||||||
| Пациенты с эпизодом гипогликемии, к-во пациентов (%) |
120 (25,6 %) | 110 (23,6 %) | 15 (6,4 %) | 146 (40,0 %) | 155 (42,5 %) | 71 (27,8%) | 6 (2,3%) |
| Эпизоды гипогликемии на один пациенто-год, к-во | 1,44 | 1,22 | 0,34 | 3,03 | 4,22 | 1,54 | 0,08 |
| Тяжелая гипогликемия** | |||||||
| Эпизоды гипогликемии на один пациенто-год, к-во | 0 | < 0,01 | 0 | 0,02 | < 0,01 | < 0,01 | 0 |
* Документированная, протекающая с клинической симптоматикой гипогликемия была эпизодом, во время которого типичные симптомы гипогликемии сочетались с установленной плазменной концентрацией глюкозы в крови ≤ 70 мг/дл (3,9 ммоль/л).
** Тяжелая, протекающая с клинической симптоматикой гипогликемия была эпизодом, потребовавшим помощи других людей для того, чтобы активно ввести углеводы, глюкагон или провести другие мероприятия, направленные на поддержание основных жизненных функций организма.
Нарушения со стороны ЖКТ
Нежелательные реакции со стороны ЖКТ (тошнота, рвота и диарея) часто регистрировались во время лечения. У пациентов, получающих лечение препаратом Соликва СолоСтар®, частота случаев тошноты, диареи и рвоты, связанных с лечением, составляла 8,4 %, 2,2 % и 2,2 % (в клинических исследованиях LixiLan-O и LixiLan-L) и 5,5%, 0,8% и 1,2%, соответственно (в клиническом исследовании LixiLan-G). Нежелательные реакции со стороны ЖКТ в основном были умеренно выраженными и преходящими.
Нарушения со стороны иммунной системы
Сообщалось о развитии аллергической реакции (крапивница), возможно связанной с применением препарата Соликва СолоСтар®, у 0,3 % пациентов.
Во время пострегистрационного применения инсулина гларгин и ликсисенатида наблюдались случаи генерализованных аллергических реакций, включая анафилактические реакции и ангионевротический отек.
Иммуногенность (образование антител)
Применение препарата Соликва СолоСтар® может привести к образованию антител к инсулину гларгин и/или ликсисенатиду (см. раздел 4.4).
После 30 недель лечения препаратом Соликва СолоСтар® в двух исследованиях фазы 3 (LixiLan-O и LixiLan-L) частота образования антител к инсулину гларгин составляла 21,0 % и 26,2 %. Примерно у 93 % пациентов антитела к инсулину гларгин продемонстрировали перекрестную реактивность c человеческим инсулином. Частота образования антител к ликсисенатиду составляла приблизительно 43 %. Наличие антител к инсулину гларгин и ликсисенатиду не оказывало клинически значимого влияния на безопасность или эффективность.
Реакции в месте введения
У некоторых пациентов (1,7%), получающих инсулинотерапию, включая препарат Соликва СолоСтар®, наблюдались эритема, локальный отек, зуд в месте инъекции. Эти явления обычно постепенно уменьшались и проходили без лечения.
Частота сердечных сокращений (ЧСС)
При применении агонистов рецепторов ГПП1 сообщалось об увеличении ЧСС, а в некоторых исследованиях ликсисенатида также наблюдалось временное увеличение ЧСС. В плацебо-контролируемых клинических исследованиях III фазы было показано отсутствие повышения средних значений ЧСС.
Заболевания кожи и подкожной клетчатки
Липодистрофия (в виде липоатрофии или липогипертрофии) и локализованный кожный амилоидоз могут возникать в месте инъекции и снижать местное всасывание лекарственного препарата. Постоянная смена места инъекции в пределах области инъекции может помочь уменьшить или предотвратить данные последствия (см. раздел 4.4). Имеются сообщения о развитии гипергликемии при повторных инъекциях в область кожного амилоидоза. При внезапном изменении места инъекции на неповрежденную область сообщалось о развитии гипогликемии.
Сообщение о подозреваемых нежелательных реакциях
Важно сообщать о подозреваемых нежелательных реакциях после регистрации лекарственного препарата с целью обеспечения непрерывного мониторинга соотношения «польза – риск» лекарственного препарата. Медицинским работникам рекомендуется сообщать о любых подозреваемых нежелательных реакциях лекарственного препарата через национальные системы сообщения о нежелательных реакциях государств – членов Евразийского экономического союза.
Российская Федерация.
адрес: 109074, г. Москва, Славянская площадь, д. 4, стр. 1.
Федеральная Служба по надзору в cфере здравоохранения.
тел.: +7 (495) 698-45-38, +7 (499) 578-02-30.
адрес электронной почты: pharm@roszdravnadzor.ru
интернет-сайт: http://www.roszdravnadzor.ru/services/npr_ais
Республика Беларусь.
адрес: 220037, г. Минск, пер. Товарищеский, 2а.
РУП "Центр экспертиз и испытаний в здравоохранении".
тел./факс: +375 17 242 00 29.
адрес электронной почты: rcpl@rceth.by
заполнить извещение о нежелательной реакции на сайте: www.rceth.by
Республика Казахстан.
адрес: г. Нур-Султан, ул. А. Иманова, д 13 (4 этаж).
РГП на ПХВ «Национальный центр экспертизы лекарственных средств и медицинских изделий» Комитета медицинского и фармацевтического контроля Министерства здравоохранения Республики Казахстан.
тeл.: 8 (7172)78-98-28.
адрес электронной почты: pdlc@dari.kz
интернет-сайт: www.ndda.kz
4.9 Передозировка
Симптомы
Имеются ограниченные клинические данные в отношении передозировки препарата Соликва СолоСтар®.
Возможно развитие гипогликемии и нежелательных реакций со стороны ЖКТ в случае превышения требуемой дозы препарата Соликва СолоСтар®.
Лечение
Эпизоды гипогликемии легкой степени выраженности обычно могут купироваться приемом легкоусвояемых углеводов внутрь. Может потребоваться коррекция дозы препарата, диеты или интенсивности физической нагрузки.
Более тяжелые эпизоды гипогликемии, вплоть до развития комы, судорог или неврологических нарушений могут купироваться внутримышечным/подкожным введением глюкагона или внутривенным введением концентрированного раствора декстрозы (глюкозы). Может потребоваться длительный прием углеводов и наблюдение врача, так как после видимого клинического улучшения возможен рецидив гипогликемии.
В зависимости от клинических проявлений и симптомов следует начать терапию, поддерживающую основные жизненные функции, а доза препарата Соликва СолоСтар® должна быть снижена до предписанной пациенту дозы.
5.1 Фармакодинамические свойства
Фармакотерапевтическая группа: гипогликемическое средство комбинированное (инсулина длительного действия
аналог + глюкагоноподобного полипептида рецепторов агонист).
Код АТХ: A10AE54.
Механизм действия
Препарат Соликва СолоСтар®
Препарат Соликва СолоСтар® является комбинированным препаратом, в состав которого входят два гипогликемических средства с дополняющими друг друга механизмами действия: инсулин гларгин, аналог инсулина длительного действия, и ликсисенатид, агонист рецепторов глюкагоноподобного пептида-1 (ГПП1). Действие препарата направлено на снижение концентрации глюкозы в крови натощак и после приема пищи (постпрандиальной концентрации глюкозы в крови), что улучшает гликемический контроль у пациентов с сахарным диабетом 2 типа, но при этом минимизируется увеличение массы тела и риск развития гипогликемии.
Инсулин гларгин
Основной функцией инсулина, в том числе инсулина гларгин, является регуляция метаболизма глюкозы. Инсулин и его аналоги снижают концентрацию глюкозы в крови, за счет увеличения потребления глюкозы периферическими тканями (в особенности, скелетными мышцами и жировой тканью) и подавления образования глюкозы в печени. Инсулин подавляет липолиз и протеолиз, а также увеличивает синтез белка.
Ликсисенатид
Ликсисенатид является агонистом рецепторов ГПП1. Рецептор ГПП1 является мишенью для нативного ГПП1, эндогенного гормона внутренней секреции, который потенцирует глюкозозависимую секрецию инсулина бета-клетками и подавляет секрецию глюкагона альфа-клетками поджелудочной железы.
Ликсисенатид стимулирует секрецию инсулина в ответ на повышение концентрации глюкозы в крови. Одновременно подавляется секреция глюкагона. Кроме этого, ликсисенатид замедляет опорожнение желудка, уменьшая за счет этого скорость абсорбции глюкозы из пищи и ее поступление в системный кровоток.
Фармакодинамические свойства
Препарат Соликва СолоСтар®
Комбинация инсулина гларгин и ликсисенатида не оказывает влияния на фармакологическое действие инсулина гларгин. Влияние комбинации инсулина гларгин и ликсисенатида на фармакологическое действие ликсисенатида в клинических исследованиях I фазы не изучалось.
Аналогично относительно постоянному профилю «концентрация/время» без выраженных пиков в течение 24 ч при введении только инсулина гларгин, при введении комбинации инсулин гларгин + ликсисенатид профиль «скорость утилизации глюкозы/время» был схожим, без выраженных пиков.
Длительность действия инсулинов, включая препарат Соликва СолоСтар®, может варьировать как у разных пациентов, так и у одного и того же пациента.
Инсулин гларгин
В клинических исследованиях инсулина гларгин (100 ЕД/мл) гипогликемическое действие внутривенно вводимого инсулина гларгин было приблизительно таким же, как и у человеческого инсулина (при внутривенном введении обоих препаратов в одинаковых дозах).
Ликсисенатид
В 28-дневном плацебо-контролируемом исследовании у пациентов с сахарным диабетов 2 типа по оценке влияния ликсисенатида в дозах 5-20 мкг 1 или 2 раза в сутки на концентрацию глюкозы в крови после приема стандартного завтрака, ликсисенатид, вводимый в этом исследовании утром в дозе 20 мкг 1 раз в сутки, поддерживал статистически значимое снижение постпрандиальной концентрации глюкозы в крови после завтрака, обеда и ужина.
После стандартизированного тестового приема меченной изотопом пищи ликсисенатид замедлял опорожнение желудка, снижая за счет этого скорость абсорбции глюкозы после приема пищи. Эффект замедления опорожнения желудка сохранялся к концу исследования.
Клиническая эффективность и безопасность
Безопасность и эффективность препарата Соликва СолоСтар® оценивались на основании гликемического контроля в ходе проведения трех рандомизированных клинических исследований у пациентов с сахарным диабетом 2 типа:
• клиническое исследование (LixiLan-O) с активным контролем, проведенном у пациентов с сахарным диабетом 2, не получавших ранее терапию инсулином и с недостаточным гликемическим контролем при применении пероральных гипогликемических препаратов;
• клиническое исследование (LixiLan-L) с активным контролем в сравнении с инсулином гларгин (переход с терапии базальным инсулином);
• клиническое исследование (LixiLan-G) с активным контролем в сравнении с агонистами рецепторов ГПП1 (переход с терапии агонистами рецепторов ГПП1).
В каждом исследовании с активным контролем лечение препаратом Соликва СолоСтар® приводило к клинически и статистически значимым улучшениям уровня гликированного гемоглобина A1c (HbA1c).
Достижение более низкого уровня HbA1c и большее снижение уровня HbA1c не приводило к увеличению частоты развития случаев гипогликемии при комбинированном лечении по сравнению с введением инсулина гларгин отдельно (см. раздел 4.8).
В клиническом исследовании при дополнении к метформину лечение начинали с 10 единиц препарата титрования дозы (10 единиц инсулина гларгин и 5 мкг ликсисенатида). В клиническом исследовании при переходе с базального инсулина начальная доза составляла 20 единиц титрования дозы (20 единиц инсулина гларгин и 10 мкг ликсисенатида) или 30 единиц препарата титрования дозы (30 единиц инсулина гларгин и 10 мкг ликсисенатида), в зависимости от предыдущей дозы инсулина. В обоих исследованиях дозу титровали 1 раз в неделю на основе измеренных значений концентрации глюкозы в плазме натощак.
Клиническое исследование с активным контролем, проведенном у пациентов с сахарным диабетом 2 типа, не получавших ранее терапию инсулином и с недостаточным гликемическим контролем при применении пероральных гипогликемических препаратов (ПГП)
1170 пациентов с сахарным диабетом 2 типа были рандомизированы в открытое, контролируемое исследование с активным контролем продолжительностью 30 недель для оценки эффективности и безопасности препарата Соликва СолоСтар® по сравнению с применением в отдельности инсулина гларгин (100 ЕД/мл) и ликсисенатида (20 мкг).
Пациенты с сахарным диабетом 2 типа, получавшие только метформин или метформин и второй ПГП (препарат сульфонилмочевины или глинид, или ингибитор натрий-глюкозных ко-транспортеров 2 типа (НГЛТ2), или ингибитор дипептидилпептидазы-4 (ДПП-4)), и которые не контролировались этой терапией (диапазон HbA1c 7,5-10% для пациентов, которые ранее получали только метформин, и 7-9% для пациентов, которые ранее получали метформин и второй ПГП), вошли в исследование сроком на 4 недели. Во время этой вводной фазы лечение метформином было оптимизировано, а применение любых других ПГП было прекращено. В конце вводной фазы пациенты, состояние которых не контролировалось должным образом (HbA1c 7-10%), были рандомизированы в группы для применения препарата Соликва СолоСтар®, инсулина гларгин или ликсисенатида. Из 1479 пациентов, начавших вводную фазу, 1170 были рандомизированы. Основными причинами отказа от перехода в рандомизированную фазу были значение глюкозы в плазме натощак (ГПН) > 13,9 ммоль/л и значение HbA1c < 7% или> 10% в конце вводной фазы.
Рандомизированные пациенты с сахарным диабетом 2 типа имели следующие характеристики: средний возраст составлял 58,4 года, причем большинство пациентов (57,1%) были в возрасте от 50 до 64 лет, 50,6% пациентов были мужчинами. Средний индекс массы тела (ИМТ) в начале исследования составил 31,7 кг/м2, у 63,4% пациентов ИМТ ≥ 30 кг/м2. Средняя продолжительность сахарного диабета составляла около 9 лет. Метформин являлся обязательной базовой терапией, при этом 58% пациентов получали второй ПГП при скрининге, при этом 54 % пациентов - сульфонилмочевину.
На неделе 30 введения препарата Соликва СолоСтар® наблюдалось статистически значимое улучшение уровня HbA1c (значение p < 0,0001) по сравнению с введением отдельных компонентов. В предварительно заданном анализе этой первичной конечной точки наблюдаемые различия соответствовали исходному уровню HbA1c (<8% или ≥8%) или исходному использованию ПГП (только метформин или метформин + второй ПГП).
См. таблицу и рисунок ниже, где указаны другие конечные точки исследования.
Результаты через 30 недель —дополнение к клиническому исследованию метформина (модифицированная ITT-популяция)
| Соликва СолоСтар® | Инсулин гларгин | Ликсисенатид | |
|---|---|---|---|
| Количество субъектов исследования (модифицированная ITT-популяция) | 468 | 466 | 233 |
| HbA1c (%) | |||
| Исходный уровень (среднее значение; после вводной фазы) | 8,1 | 8,1 | 8,1 |
| Завершение исследования (среднее значение) | 6,5 | 6,8 | 7,3 |
| Изменение среднеквадратичного значения по сравнению с исходным уровнем (среднее значение) | -1,6 | -1,3 | -0,9 |
| Разница по сравнению с инсулином гларгин 95 % доверительный интервал (значение р) |
-0,3 [-0,4, -0,2] (< 0,0001) |
||
| Разница по сравнению с ликсисенатидом 95 % доверительный интервал (значение р) |
-0,8 [-0,9, -0,7] (< 0,0001) |
||
| Количество пациентов (%), которые достигли уровня HbA1c <7 % на неделе 30 лечения* | 345 (74 %) | 277 (59 %) | 77 (33 %) |
| Уровень глюкозы в плазме натощак (ммоль/л) | |||
| Исходный уровень (среднее значение) | 9,88 | 9,75 | 9,79 |
| Завершение исследования (среднее значение) | 6,32 | 6,53 | 8,27 |
| Изменение среднеквадратичного значения по сравнению с исходным уровнем (среднее значение) | -3,46 | -3,27 | -1,50 |
| Разница среднеквадратичного значения по сравнению с гларгином (среднее значение) (95 % ДИ) (значение р) |
-0,19 [от -0,420 до 0,038] (0,1017) |
||
| Разница среднеквадратичного значения по сравнению с ликсисенатидом (среднее значение) (95 % ДИ) (значение р) |
-1,96 [от -2,246 до -1,682] (< 0,0001) |
||
| Постпрандиальная гликемия через 2 часа (ммоль/л)** | |||
| Исходный уровень (среднее значение) | 15,19 | 14,61 | 14,72 |
| Завершение исследования (среднее значение) | 9,15 | 11,35 | 9,99 |
| Изменение среднеквадратичного значения по сравнению с исходным уровнем | -5,68 | -3,31 | -4,58 |
| Разница среднеквадратичного значения по сравнению с гларгином (среднее значение) (95 % ДИ) |
-2,38 [от -2,79 до -1,96] |
||
| Разница среднеквадратичного значения по сравнению с ликсисенатидом (среднее значение) (95 % ДИ) |
-1,10 [от -1,63 до -0,57] |
||
| Средняя масса тела (кг) | |||
| Исходный уровень (среднее значение) | 89,4 | 89,8 | 90,8 |
| Изменение среднеквадратичного значения по сравнению с исходным уровнем (среднее значение) | -0,3 | 1,1 | -2,3 |
| Сравнение с инсулином гларгин
95 % доверительный интервал (значение р) |
-1,4 [от -1,9 до -0,9] (< 0,0001) |
||
| Сравнение с ликсисенатидом 95 % доверительный интервал* |
2,01 [от 1,4 до 2,6] |
||
| Количество (%) пациентов, достигших уровня HbA1c < 7,0 % без увеличения массы тела на неделе 30 лечения | 202 (43,2) |
117 (25,1) |
65
(27,9 %) |
| Разница в доле пациентов по сравнению с группой применения инсулина гларгин 95 % доверительный интервал (значение р) |
18,1 [от 12,2 до 24,0] (< 0,0001) |
||
| Разница в доле пациентов по сравнению с группой применения ликсисенатида 95 % доверительный интервал* |
15,2 [от 8,1 до 22,4] |
||
| Суточная доза инсулина гларгин | |||
| Среднеквадратичная доза инсулина на неделе 30 (среднее значение) |
39,8 | 40,5 | Не применимо |
*Не включено в предварительно установленную методику последовательных испытаний
**Постпрандиальная гликемия через 2 часа минус концентрация глюкозы перед приемом пищи
Рисунок 1. Средний уровень HbA1c (%) при посещении в течение 30-недельного рандомизированного периода лечения
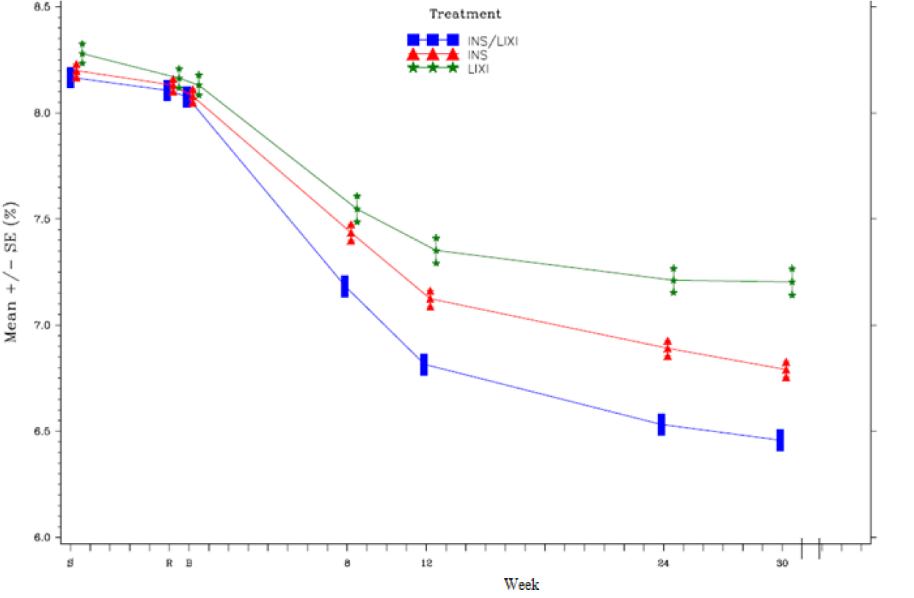
В группе пациентов, получавших препарат Соликва СолоСтар®, было получено о статистически значимо большее снижение среднего 7-точечного уровня глюкозы в плазме при самоконтроле по сравнению с исходным уровнем на неделе 30 (–3,35 ммоль/л) по сравнению с пациентами в группе инсулина гларгин (–2,66 ммоль/л; разница –0,69 ммоль/л) и с пациентами в группе ликсисенатида (–1,95 ммоль/л; разница –1,40 ммоль/л) (р < 0,0001 для обеих групп). Во все моменты времени средняя концентрация глюкозы в плазме на неделе 30 был ниже в группе препарата Соликва СолоСтар®, чем в группе инсулина гларгин и в группе ликсисенатида, за исключением единственного значения до приема завтрака, которое было схожим в группе препарата Соликва СолоСтар® и инсулина гларгин.
Клиническое исследование с активным контролем в сравнении с инсулином гларгин (переход с терапии базальным инсулином)
736 пациентов с сахарным диабетом 2 типа приняли участие в рандомизированном, открытом, многоцентровом исследовании с активным контролем продолжительностью 30 недель в двух параллельных группах лечения для оценки эффективности и безопасности препарата Соликва СолоСтар® по сравнению с инсулином гларгин (100 ЕД/мл).
Пациенты с сахарным диабетом 2 типа, прошедшие скрининг, получали лечение базальным инсулином в течение, по крайней мере, 6 месяцев, с применением стабильной суточной дозы от 15 до 40 единиц отдельно или в сочетании с одним или двумя ПГП (метформин или сульфонилмочевина, или глинид, или ингибитор НГЛТ2, или ингибитор ДПП-4), уровень HbA1c составил 7,5-10% (средний уровень HbA1c 8,5% при скрининге) и концентрация ГПН ≤ 10,0 ммоль/л или 11,1 ммоль/л в зависимости от предыдущего лечения.
После скрининга пациенты, подходящие для участия в исследовании (n=1018), были включены в вводную фазу исследования продолжительностью 6 недель, где они проходили лечение, или были переведены на инсулин гларгин, в случае, если они применяли другой базальный инсулин. Титровали/стабилизировали дозу инсулина при сопутствующем применении метформина (если его использовали ранее). Прием других ПГП был прекращен.
По окончании вводной фазы пациенты с уровнем HbA1c 7-10 %, концентрацией ГПН ≤ 7,77 ммоль/л и суточной дозой инсулина гларгин от 20 до 50 единиц были рандомизированы в группу применения препарата Соликва СолоСтар® (n = 367) либо инсулина гларгин (n = 369).
У пациентов с сахарным диабетом 2 типа были следующие характеристики: средний возраст составлял 60,0 лет, причем большинство пациентов (56,3%) были в возрасте от 50 до 64 лет, а 53,3% пациентов были женщинами. Средний ИМТ в начале исследования составил 31,1 кг/м2, у 57,3% пациентов ИМТ ≥ 30 кг/м2. Средняя продолжительность сахарного диабета составляла приблизительно 12 лет, а средняя продолжительность предшествующего исследованию лечения на основе базального инсулина составляла приблизительно 3 года. При скрининге 64,4% пациентов получали инсулин гларгин в качестве базального инсулина, а 95,0% пациентов получали как минимум один сопутствующий ПГП.
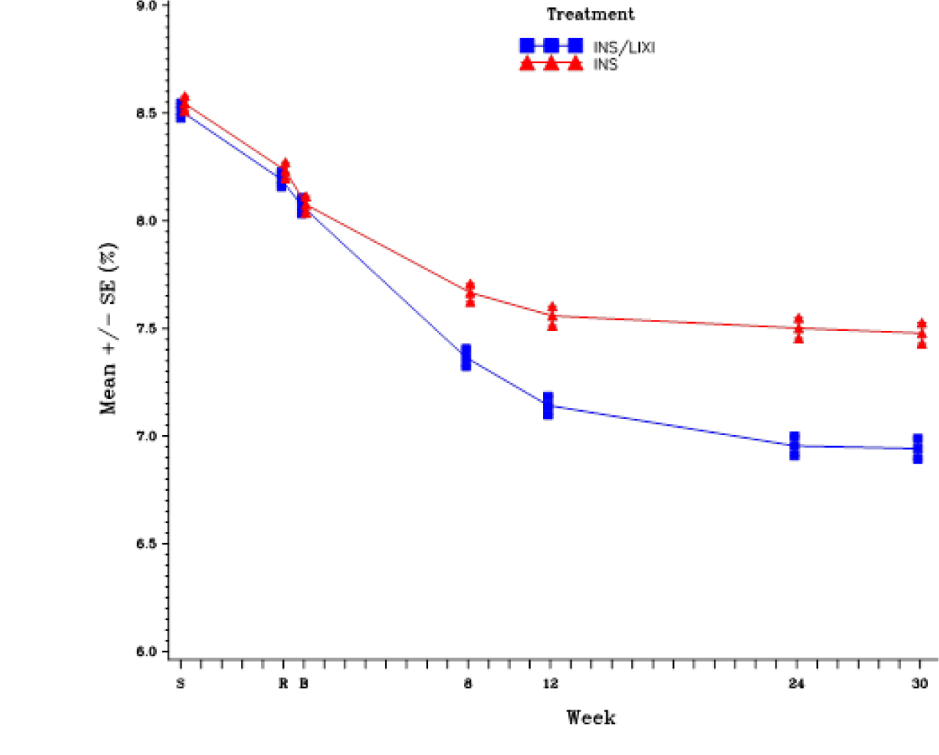
На неделе 30 применения препарата Соликва СолоСтар® наблюдалось статистически значимое улучшение уровня HbA1c (значение p < 0,0001) по сравнению с введением инсулина гларгин.
См. таблицу и рисунок ниже, где указаны другие конечные точки исследования.
Результаты через 30 недель исследования модифицированной ITT-популяции с неконтролируемым сахарным диабетом 2 типа, которой вводили базальный инсулин.
| Соликва СолоСтар® | Инсулин гларгин | ||
|---|---|---|---|
| Количество субъектов исследования (модифицированная ITT-популяция) | 366 | 365 | |
| HbA1c (%) | |||
| Исходный уровень (среднее значение; после вводной фазы) | 8,1 | 8,1 | |
| Окончание лечения (среднее значение) | 6,9 | 7,5 | |
| Изменение среднеквадратичного значения по сравнению с исходным уровнем (среднее значение) | -1,1 | -0,6 | |
| Разница по сравнению с инсулином гларгин 95 % доверительный интервал (значение р) |
-0,5 [-0,6, -0,4] (< 0,0001) |
||
| Количество пациентов (n, %), которые достигли уровня HbA1c < 7 % на неделе 30 * | 201 (54,9 %) | 108 (29,6 %) | |
| Уровень глюкозы в плазме натощак (ммоль/л) | |||
| Исходный уровень (среднее значение) | 7,33 | 7,32 | |
| Завершение исследования (среднее значение) | 6,78 | 6,69 | |
| Изменение среднеквадратичного значения по сравнению с исходным уровнем (среднее значение) | -0,35 | -0,46 | |
| Разница по сравнению с инсулином гларгин 95 % доверительный интервал |
-0,11 [от -0,21 до 0,43] |
||
| Постпрандиальная гликемия через 2 часа (ммоль/л)** | |||
| Исходный уровень (среднее значение) | 14,85 | 14,97 | |
| Завершение исследования (среднее значение) | 9,91 | 13,41 | |
| Изменение среднеквадратичного значения по сравнению с исходным уровнем (среднее значение) | -4,72 | -1,39 | |
| Разница среднеквадратичного значения по сравнению с гларгином (среднее значение) (95 % ДИ) |
-3,33 [от -3,89 до -2,77] |
||
| Средняя масса тела (кг) | |||
| Исходный уровень (среднее значение) | 87,8 | 87,1 | |
| Изменение среднеквадратичного значения по сравнению с исходным уровнем (среднее значение) | -0,7 | 0,7 | |
| Сравнение с инсулином гларгин
95 % доверительный интервал (значение р) |
-1,4 [от -1,8 до -0,9] (< 0,0001) |
||
| Количество (%) пациентов, достигших уровня HbA1c < 7,0 % без увеличения массы тела на неделе 30 | 125 (34,2) |
49 (13,4) |
|
| Разница в доле пациентов по сравнению с группой применения инсулина гларгин 95 % доверительный интервал (значение р) |
20,8 [от 15,0 до 26,7] (< 0,0001) |
||
| Суточная доза инсулина гларгин | |||
| Исходный уровень (среднее значение) | 35,0 | 35,2 | |
| Конечная точка (средняя) | 46,7 | 46,7 | |
| Изменение среднеквадратичной дозы инсулина на неделе 30 (среднее значение) | 10,6 | 10,9 | |
*Не включено в предварительно установленную методику последовательных испытаний
**Постпрандиальная гликемия через 2 часа минус концентрация глюкозы перед приемом пищи
Рисунок 2. Среднее значение HbA1c (%) при посещении в течение 30-недельного рандомизированного периода лечения
Клиническое исследование с активным контролем в сравнении с агонистами рецепторов ГПП1 (переход с терапии агонистами рецепторов ГПП1)
Эффективность и безопасность препарата Соликва СолоСтар® по сравнению с неизмененным до исследования лечением агонистом рецептора ГПП1 изучали в ходе 26-недельного открытого рандомизированного исследования. В исследование были включены 514 пациентов с сахарным диабетом 2 типа, не достигшие надлежащего контроля заболевания (уровень HbA1c 7-9% включительно) при лечении на протяжении, по меньшей мере, 4 месяцев лираглутидом и эксенатидом или дулаглутидом, албиглутидом либо эксенатидом пролонгированного действия на протяжении по меньшей мере 6 месяцев в максимальной переносимой дозе в сочетании с метформином в отдельности или в комбинации с пиоглитазоном, ингибитором НГЛТ2 или обоими препаратами. Пациенты, соответствовавшие критериям включения, были рандомизированы в группы применения препарата Соликва СолоСтар® или предшествующего агониста рецептора ГПП1 в дополнение к предшествующему лечению ПГП.
На момент скринингового обследования 59,7% участников исследования принимали агонисты рецептора ГПП1 1 или 2 раза в сутки, и 40,3% пациентов принимали агонисты рецептора ГПП1 1 раз в неделю. На момент скринингового обследования 6,6% участников исследования принимали пиоглитазон, и 10,1% участников принимали ингибитор НГЛТ2 в комбинации с метформином. Характеристики исследуемой популяции: средний возраст 59,6 лет, 52,5% участников исследования — мужчины. Средняя продолжительность диабета составила 11 лет, средняя продолжительность предшествующей терапии агонистом рецептора ГПП1 составила 1,9 года, средний ИМТ составил приблизительно 32,9 кг/м2, средняя рСКФ составила 87,3 мл/мин/1,73 м2, у 90,7% пациентов рСКФ составила ≥ 60 мл/мин.
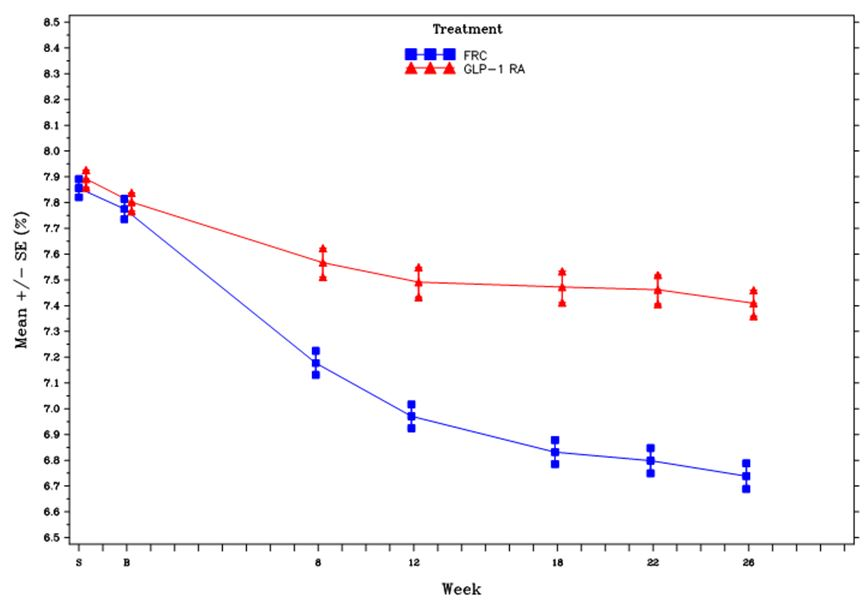
На 26-й неделе в группе применения препарата Соликва СолоСтар® наблюдалось статистически значимое улучшение уровней HbA1c (p < 0,0001). Результаты запланированного анализа по подтипу агониста рецептора ГПП1 (лекарственная форма для приема 1-2 раза в сутки или 1 раз в неделю), выполненного при скрининге, указывали на то, что изменение уровней HbA1c на 26-й неделе было схожим между всеми подгруппами и согласовывалось с данными первичного анализа в общей популяции. На 26-й неделе средняя суточная доза препарата Соликва СолоСтар® составила 43,5 единицы дозы.
Другие целевые критерии исследования см. в таблице и на рисунке ниже.
Результаты 26-недельного исследования у пациентов в модифицированной популяции ITT с неконтролируемым сахарным диабетом 2-го типа, получавших лечение агонистами рецептора ГПП1
| Соликва СолоСтар® | Инсулин гларгин | |
|---|---|---|
| Количество субъектов исследования (mITT) | 252 | 253 |
| HbA1c (%) | ||
| Исходный уровень (среднее значение; после вводной фазы) | 7,8 | 7,8 |
| Окончание лечения (среднее значение) | 6,7 | 7,4 |
| Изменение, рассчитанное методом НК, относительно исходного уровня (среднее значение) | -1,0 | -0,4 |
| Разница по сравнению с агонистом рецептора ГПП1 (95 % доверительный интервал) (величина р) |
-0,6 [-0,8, -0,5] (< 0,0001) |
|
| Количество пациентов (n, %), достигших уровня HbA1c < 7 % на 26-й неделе | 156 (61,9 %) | 65 (25,7 %) |
| Разница в доле пациентов (95 % доверительный интервал) в сравнении с агонистом рецептора ГПП1 | 36,1 % (от 28,1 до 44,0 %) | |
| Величина р | < 0,0001 | |
| Концентрация глюкозы в плазме натощак (ммоль/л) | ||
| Исходный уровень (среднее значение) | 9,06 | 9,06 |
| Окончание исследования (среднее значение) | 6,86 | 8,66 |
| Изменение, рассчитанное методом НК, относительно исходного уровня (среднее значение) | -2,28 | --0,60 |
| Разница по сравнению с агонистом рецептора ГПП1 (95 % доверительный интервал) (величина р) |
-1,67 (от -2,00 до -1,34) (< 0,0001) |
|
| ППГ через 2 часа (ммоль/л)* | ||
| Исходный уровень (среднее значение) | 13,60 | 13,78 |
| Окончание исследования (среднее значение) | 9,68 | 12,59 |
| Изменение, рассчитанное методом НК, относительно исходного уровня (среднее значение) | -4,0 | -1,11 |
| Разность средних значений, рассчитанная методом НК, по сравнению с агонистом
рецептора GLP-1 (среднее значение) (95 % доверительный интервал) (величина р) |
-2,9 (от -3,42 до -2,28) (< 0,0001) |
|
| Средняя масса тела (кг) | ||
| Исходный уровень (среднее значение) | 93,01 | 95,49 |
| Изменение, рассчитанное методом НК, относительно исходного уровня (среднее значение) | 1,89 | -1,14 |
| Сравнение с агонистом рецептора GLP-1 (95 % доверительный интервал) (величина р) |
-3,03 (2,417–3,643) (< 0,0001) |
|
**ППГ через 2 часа минус концентрация глюкозы перед приемом пищи
Сочетанное применение препарата Соликва СолоСтар® и ингибиторов НГЛТ2
Целесообразность сочетанного применения препарата Соликва СолоСтар® и ингибиторов НГЛТ2 подтверждается результатами анализа в подгруппах, выполненного в рамках трех рандомизированных клинических исследований III фазы (119 пациентов, принимавших комбинацию с фиксированным соотношением инсулина гларгин/ликсисенатида, которые также принимали ингибиторы НГЛТ2).
Одно исследование, проведенное в Европе и Северной Америке, включало данные 26 пациентов (10,1 %), которые одновременно принимали комбинацию с фиксированным соотношением инсулина гларгин/ликсисенатида, метформин и ингибитор НГЛТ2. Еще два исследования III фазы, проведенных в рамках специально разработанной японской программы клинической разработки у пациентов, не достигших достаточного гликемического контроля при использовании пероральных противодиабетических средств, предоставили данные 59 пациентов (22,7 %) и 34 пациентов (21,1 %) соответственно, которые одновременно принимали ингибиторы НГЛТ2 и комбинацию с фиксированным соотношением инсулина гларгин/ликсисенатида.
Данные, полученные в ходе этих трех исследований, указывают на то, что назначение препарата Соликва СолоСтар® пациентам, у которых не удается достичь надлежащего контроля заболевания при терапии, включающей ингибиторы НГЛТ2, ведет к благоприятному изменению уровня HbA1c в отличие от препаратов сравнения. У пациентов, принимавших ингибиторы НГЛТ2, и пациентов, не принимавших ингибиторы НГЛТ2, не наблюдалось повышенного риска развития гипогликемии и существенной разницы в совокупном профиле безопасности.
Исследования исходов сердечно-сосудистых заболеваний
Безопасность инсулина гларгин и ликсисенатида при сердечно-сосудистых заболеваниях была подтверждена в ходе проведения клинических исследований ORIGIN и ELIXA, соответственно. Не проводилось отдельного исследования сердечно-сосудистых заболеваний при применении препарата Соликва СолоСтар®.
Инсулин гларгин
Интервенционное исследование на основе инсулина гларгин (исследование ORIGIN) представляет собой открытое рандомизированное исследование с участием 12537 пациентов, в котором лечение препаратом Лантус сравнили со стандартным лечением на момент первого появления серьезной нежелательной реакции со стороны сердечно-сосудистой системы. Осложнение, связанное с сердечно-сосудистым заболеванием (ССО) определяли как совокупность смертельных исходов по причине сердечно-сосудистых заболеваний, нефатальный инфаркта миокарда и нефатальный инсульта. Средняя продолжительность последующего наблюдения составила 6,2 года. Частота возникновения ССО была одинаковой в группе приема препарата Лантус и в группе стандартного лечения в исследовании ORIGIN. Коэффициент риска (95% ДИ) для ССО: 1,02 (0,94, 1,11).
Ликсисенатид
Исследование ELIXA представляет собой рандомизированное, двойное, слепое, плацебо-контролируемое, многонациональное исследование по оценке развития сердечно-сосудистых (СС) заболеваний во время лечения ликсисенатидом у пациентов (n = 6068) с сахарным диабетом 2 типа после недавно перенесенного острого коронарного синдрома. Основной комбинированной конечной точкой являлось время до развития любого из следующих событий: Смерть по причине сердечно-сосудистого заболевания, нефатальный инфаркт миокарда, нефатальный инсульт или госпитализация по причине нестабильной стенокардии. Средняя продолжительности последующего наблюдения составила 25,8 и 25,7 месяцев в группе приема ликсисенатида и в группе плацебо, соответственно.
Частота достижения основной конечной точки была одинаковой в группах приема ликсисенатида (13,4%) и плацебо (13,2%): отношение рисков (ОР) в группе приема ликсисенатида по сравнению с группой плацебо составляло 1,017 с соответствующим двусторонним 95% доверительным интервалом (ДИ) от 0,886 до 1,168.
5.2 Фармакокинетические свойства
Абсорбция
Соотношение инсулина гларгин и ликсисенатида не оказывает существенного влияния на фармакокинетику инсулина гларгин и ликсисенатида в группе применения препарата Соликва СолоСтар®.
После подкожного введения комбинации инсулин гларгин + ликсисенатид пациентам с сахарным диабетом 1 типа не было обнаружено выраженной максимальной концентрации (Cmax) инсулина гларгин. Экспозиция инсулина гларгин после введения комбинации инсулин гларгин + ликсисенатид составила 86–88 % по сравнению с аналогичным показателем, наблюдаемым при выполнением отдельных единовременных инъекций инсулина гларгин и ликсисенатида. Данное различие не считается клинически значимым.
После подкожного введения комбинации инсулин гларгин + ликсисенатид пациентам с сахарным диабетом 1 типа медиана времени достижения Cmax ликсисенатида находилась в диапазоне от 2,5 до 3,0 часов. Значение AUC было сопоставимо, хотя наблюдалось небольшое снижение Cmax ликсисенатида на 22–34 % по сравнению с выполнением отдельных единовременных инъекций инсулина гларгин и ликсисенатида, которое не являлось клинически значимым.
Не отмечалось клинически значимых различий в скорости всасывания ликсисенатида при его подкожном введении в качестве монотерапии в область живота, плечо или бедра.
Распределение
Ликсисенатид имеет низкую степень (55%) связывания с белками плазмы крови у человека. Видимый объем распределения (Vd) ликсисенатида после подкожного введения комбинации инсулин гларгин + ликсисенатид составляет приблизительно 100 л. Видимый Vd инсулина гларгин после подкожного введения комбинации препарата инсулин гларгин + ликсисенатид составляет примерно 1700 л.
Биотрансформация и элиминация
Изучение метаболизма у пациентов с сахарным диабетом, которые получали только инсулин гларгин, показывает, что инсулин гларгин быстро метаболизируется на карбоксильном конце В-цепи с образованием двух активных метаболитов: M1 (21A-Gly-инсулин) и M2 (21A-Gly-des-30B-Thr-инсулин). В плазме основным циркулирующим соединением является метаболит М1. Фармакокинетические и фармакодинамические данные подтверждают, что эффект подкожной инъекции инсулина гларгин основан главным образом на воздействии М1.
Как пептид, ликсисенатид выводится путем клубочковой фильтрации с последующей реабсорбцией в канальцах и последующей метаболической деградацией. Это уменьшает количество пептидов и аминокислот, которые участвуют в процессе метаболизма белка. После введения нескольких доз препарата пациентам с сахарным диабетом 2 типа средний конечный период полувыведения составил приблизительно 3 часа, а средний видимый клиренс - около 35 л/ч.
Почечная недостаточность
У пациентов с почечной недостаточностью легкой степени (клиренс креатинина, рассчитанный по формуле Кокрофта-Голта, составляет 60–90 мл/мин), средней степени (клиренс креатинина составляет 30–60 мл/мин) и тяжелой степени (клиренс креатинина составляет 15–30 мл/мин) AUC ликсисенатида был увеличен на 46 %, 51 % и 87 % соответственно.
Применение инсулина гларгин не было изучено у пациентов с почечной недостаточностью. Однако у пациентов с почечной недостаточностью потребность в инсулине может уменьшаться ввиду замедленного метаболизма инсулина.
Печеночная недостаточность
Поскольку ликсисенатид выводится в основном через почки, не проводились фармакокинетические исследования с участием пациентов с острым или хроническим нарушением функции печени. Не ожидается, что нарушение функции печени может оказать влияние на фармакокинетику ликсисенатида.
Применение инсулина гларгин не было изучено у пациентов с сахарным диабетом, страдающих нарушением функции печени. У пациентов с нарушением функции печени потребность в инсулине может уменьшаться ввиду сниженной способности к гликонеогенезу и замедленного метаболизма инсулина.
Возраст, раса, пол и масса тела
Инсулин гларгин
Не оценивалось влияние возраста, расы и пола пациентов на фармакокинетику инсулина гларгин. В ходе проведения контролируемых клинических исследований с участием взрослых пациентов, которым вводили инсулин гларгин (100 ЕД/мл), выполнили анализ подгрупп по возрасту, расовому и половому признаку. Не наблюдалось различий в безопасности и эффективности препарата.
Ликсисенатид
Возраст не оказывает клинически значимого влияния на фармакокинетику ликсисенатида. В ходе проведения фармакокинетического исследования пациентов пожилого возраста без сахарного диабета установили, что введение ликсисенатида в дозе 20 мкг привело к среднему увеличению AUC ликсисенатида на 29 % среди пациентов пожилого возраста (11 пациентов в возрасте от 65 до 74 лет и 7 пациентов в возрасте 75 лет и старше) по сравнению с 18 пациентами в возрасте от 18 до 45 лет. Это может быть связано со снижением функции почек у пациентов старшей возрастной группы.
Этническое происхождение пациентов не оказало клинически значимого влияния на фармакокинетику ликсисенатида, что подтверждается результатами фармакокинетических исследований пациентов из Кавказа, Японии и Китая.
Половой признак пациентов не оказывает клинически значимого влияния на фармакокинетику ликсисенатида.
Масса тела не оказывает клинически значимого влияния на AUC ликсисенатида.
Дети
Исследования препарата Соликва СолоСтар® с участием детей и подростков в возрасте до 18 лет не проводились.
5.3 Доклинические данные по безопасности
Не проводилось каких-либо исследований на животных по изучению комбинации инсулин гларгин + ликсисенатид для оценки токсичности повторных доз, канцерогенного действия, генотоксичности или репродуктивной токсичности.
Инсулин гларгин
Данные доклинического исследования инсулина гларгин подтверждают отсутствие опасности для человека, что обосновано результатами стандартных исследований фармакологии безопасности, токсичности многократных доз, генотоксичности, канцерогенного действия, репродуктивной токсичности.
Ликсисенатид
В ходе проведения двухлетних исследований подкожной канцерогенности были обнаружены нелетальные С-клеточные опухоли щитовидной железы у крыс и мышей. Считается, что они вызваны негенотоксическим опосредованным рецептором ГПП1, к которому грызуны особенно чувствительны. Были обнаружены гиперплазия C-клеток и аденома при всех дозах препарата у крыс. Не установлена максимальная доза, при которой не проявляется нежелательный эффект препарата (NOAEL). У мышей такой эффект был выявлен при степени воздействия, превышающей в 9,3 раза терапевтическую дозу для человека. У мышей не наблюдалось C-клеточной карциномы, а у крыс была зарегистрирована C-клеточная карцинома при степени воздействия, превышающей в 900 раз терапевтическую дозу для человека.
В ходе проведения двухлетнего исследования подкожной канцерогенности на мышах были зарегистрированы 3 случая развития аденокарциномы в эндометрии в группе введения средней дозы препарата со статистически значимым увеличением, соответствующим 97-кратной степени воздействия. Не был установлен эффект, связанный с проводимым лечением.
При проведении исследований на животных не было выявлено непосредственного вредного воздействия на фертильность у самцов и самок у крыс. У собак, получавших ликсисенатид, наблюдались обратимые повреждения семенников и эпидидимальных клеток. У здоровых мужчин не отмечалось какого-либо влияния на сперматогенез, связанного с проводимым лечением.
При проведении исследований эмбриофетального развития крыс наблюдались пороки развития, задержка роста, задержка окостенения и изменение скелета крыс при всех дозах воздействия ликсисенатида (5-кратное воздействие по сравнению с воздействием на человека) и у кроликов при высоких дозах воздействия (32-кратное воздействие по сравнению с воздействием на человека). У обоих видов животных наблюдалась легкая степень токсического действия на материнский организм, что проявлялось в виде низкого потребления пищи и снижении массы тела. У новорожденных самцов крыс, подвергшихся воздействию высоких доз ликсисенатида во время поздней беременности и в период лактации, наблюдалось замедление роста, при этом наблюдалась несколько увеличенная смертность щенков.
6.1 Перечень вспомогательных веществ
Метакрезол (м-крезол)
Глицерол (85%)
Метионин (L-метионин)
Цинка хлорид
Хлористоводородная кислота
Натрия гидроксид
Вода для инъекций
6.2 Несовместимость
В связи с отсутствием исследований совместимости, данный лекарственный препарат нельзя смешивать с другими лекарственными препаратами.
6.3 Срок годности (срок хранения)
2 года.
6.4 Особые меры предосторожности при хранении
При температуре от 2 °С до 8 °С в защищенном от света месте. Не замораживать.
6.5 Характер и содержание первичной упаковки
По 3 мл препарата в картридж из бесцветного стекла (тип I). Картридж обжат с одной стороны алюминиевым колпачком с уплотнительным диском и укупорен с другой – плунжером. Картридж вмонтирован в одноразовую шприц-ручку СолоСтар®. По 3 или 5 шприц-ручек СолоСтар® вместе с листком-вкладышем в картонную пачку, снабженную картонным фиксатором.
6.6 Особые меры предосторожности при уничтожении использованного лекарственного препарата или отходов, полученных после применения лекарственного препарата и другие манипуляции с препаратом
Картридж следует проверить перед использованием. Его следует использовать только в том случае, если раствор чистый, бесцветный, водянистой консистенции и без видимых твердых частиц.
Перед каждым использованием следует устанавливать новую иглу. Иглы нельзя использовать повторно. После каждой инъекции игла пациента должна быть выброшена.
Пустые шприц-ручки не могут быть использованы повторно, их следует утилизировать надлежащим образом.
В целях предотвращения возможной передачи возбудителей инфекции каждая шприц-ручка должна использоваться только одним пациентом.
Нет особых требований к утилизации.
Весь оставшийся лекарственный препарат и отходы следует уничтожать в установленном порядке.
В шприц-ручках Соликва СолоСтар® содержится инсулин гларгин и ликсисенатид в фиксированном соотношении.
Лекарственная комбинация в шприц-ручке Соликва СолоСтар® 10-40 предназначена для ежедневного введения от 10 до 40 ЕД инсулина гларгин и от 5 мкг до 20 мкг ликсисенатида.
- Никогда не используйте иглы повторно. В случае повторного использования иглы Вы можете не получить нужную Вам дозу (введение меньшей дозы) или получить слишком большую дозу (передозировка), так как возможна закупорка иглы.
- Никогда не используйте шприц для извлечения препарата из шприц-ручки. При использовании шприца Вы не сможете получить правильное количество препарата.
Сохраните эту инструкцию для обращения к ней за справками в будущем.
Важная информация
• Никогда не пользуйтесь одной шприц-ручкой одновременно с другим человеком – она предназначена для индивидуального использования.
• Никогда не пользуйтесь шприц-ручкой, если она повреждена или Вы не уверены в том, что она исправна.
• Всегда проводите тест на безопасность.
• Всегда имейте при себе запасную шприц-ручку и запасные иглы, на тот случай, если они потеряются или станут неисправными.
• Перед тем, как начать пользоваться шприц-ручкой, узнайте у медицинского работника, как правильно проводить подкожную инъекцию.
• В случае наличия у Вас затруднений при обращении с этой шприц-ручкой, например, в случае проблем со зрением, Вам может потребоваться помощь других лиц, способных следовать всем рекомендациям данной инструкции по пользованию шприц-ручкой Соликва СолоСтар®.
• Перед использованием шприц-ручки, прочитайте эту инструкцию. Если Вы не будете следовать всем ее рекомендациям, Вы можете получить слишком много или слишком мало препарата.
Дополнительные средства, которые Вам потребуются:
• Новая стерильная игла (см. ШАГ 2).
• Спиртовая салфетка.
• Резистентный к проколам контейнер для использованных игл и шприц-ручек (см. раздел «Утилизация шприц-ручек»).
Указание мест для проведения инъекций
Внешний вид шприц-ручки Соликва СолоСтар® 10-40

*Вы можете не видеть плунжер, пока не введете несколько доз.
ШАГ 1: Проверка шприц-ручки
Выньте новую шприц-ручку из холодильника не менее чем за 1 час до проведения инъекции.
Введение
холодного препарата является более болезненным.
A. Проверка названия и срока годности на этикетке шприц-ручки.
Удостоверьтесь в том, что у Вас правильный (нужный Вам) препарат. Шприц-ручка Соликва СолоСтар® 10-40 имеет желтый цвет.
• Не используйте шприц-ручку Соликва СолоСтар® 10-40, если Вы нуждаетесь в суточной дозе менее 10 единиц или больше 40 единиц препарата.
• Не используйте шприц-ручку после окончания срока годности.

B. Снимите колпачок со шприц-ручки.
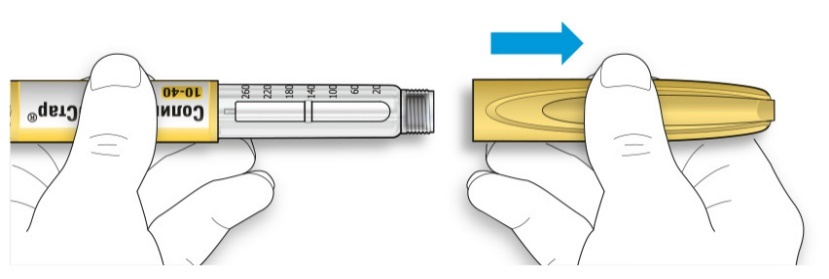
C. Проверьте прозрачность препарата.
• Не используйте шприц-ручку, если раствор препарата мутный, имеет окраску или содержит частицы.
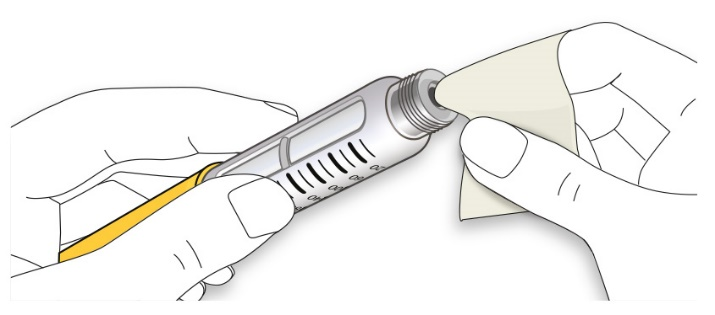
D. Протрите резиновую герметизирующую пробку спиртовой салфеткой.
Если у Вас имеются другие шприц-ручки
• Если Вы имеете другие шприц-ручки, особенно важно удостовериться в том, что Вы взяли правильный (нужный Вам) препарат.
ШАГ 2: Присоединение новой иглы
• Не используйте иглы повторно. Всегда используйте новую стерильную иглу для каждой инъекции. Это поможет предотвратить закупорку иглы, контаминацию (загрязнение) иглы и инфекцию.
• Всегда используйте иглы, которые совместимы со шприц ручкой Соликва СолоСтар®, например, иглы BD Микро-Файн® Плюс (BD Micro-Fine® Plus), Юнифайн® Пентипс® Плюс (Unifine® Pentips® Plus), Инсупен (Insupen).
A. Возьмите новую иглу и удалите защитное покрытие.
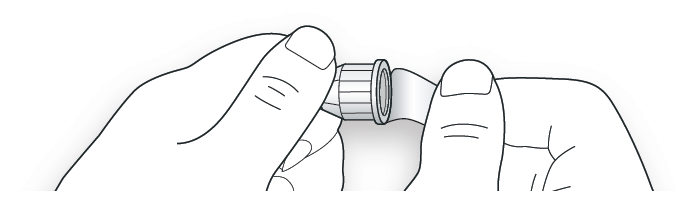
B. Держите иглу прямо перед шприц-ручкой и прикрутите ее на шприц-ручку до фиксации. Не прилагайте чрезмерных усилий при прикручивании иглы.
C. Снимите наружный колпачок иглы. Сохраните его для использования в дальнейшем.
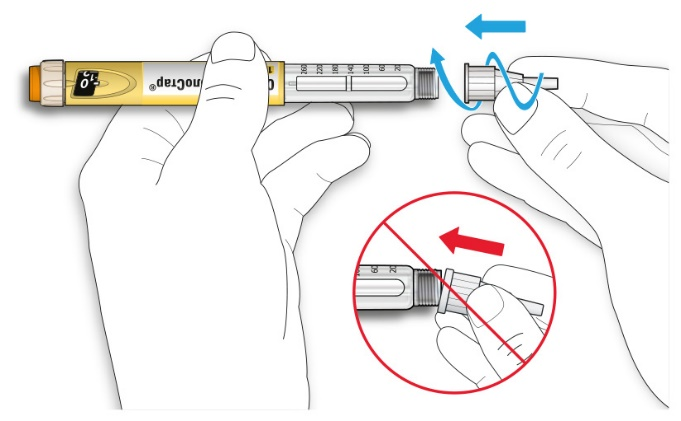
D. Снимите внутренний колпачок с иглы и выбросьте его.
Обращение с иглами
• Будьте осторожны при обращении с иглами - это предотвратит повреждение иглой и перекрестное инфицирование.
ШАГ 3: Проведите тест на безопасность
Обязательно перед каждой инъекцией проводите тест на безопасность - он проводится для проверки того, что шприц-ручка и игла работают надлежащим образом, а также для того, чтобы быть уверенным, что Вы введете правильную дозу препарата.
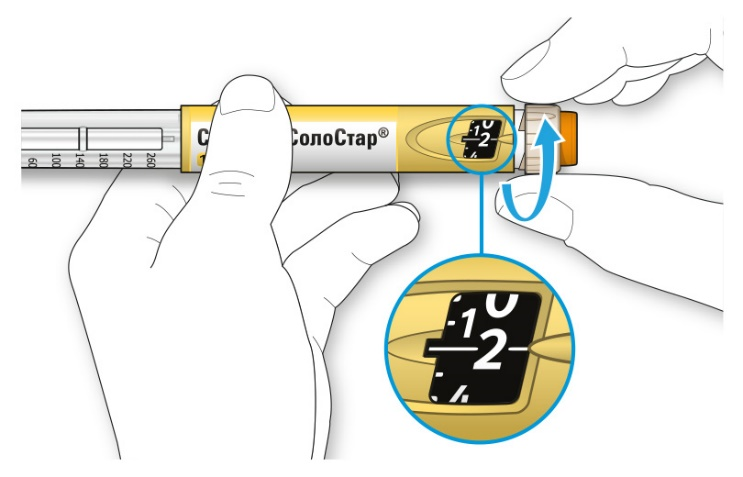
A. Наберите 2 единицы препарата путем вращения селектора дозы до того момента, когда указатель дозы не окажется на отметке 2.
B. Нажмите до упора на кнопку ввода дозы.
• Если препарат выходит из кончика иглы, шприц-ручка работает правильно.
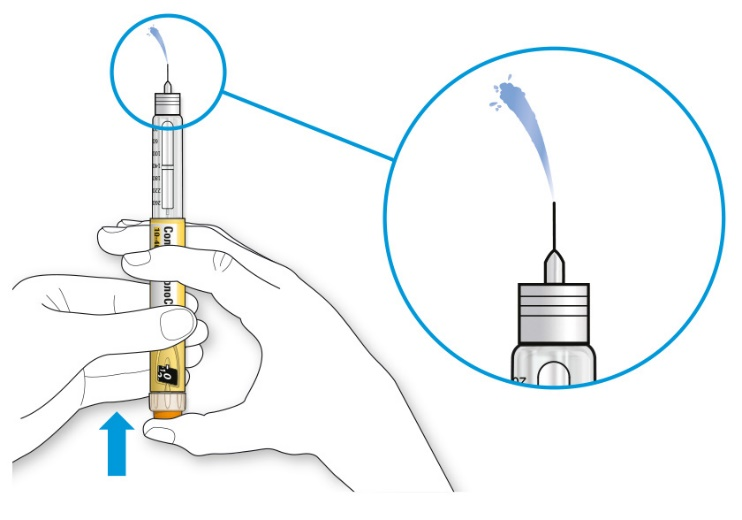
Если жидкость не показывается из кончика иглы:
• Вам может потребоваться повторить этот шаг до 3-х раз, перед тем как покажется препарат.
• Если препарат не выходит из кончика иглы после третьего повтора этого шага, возможно, имеет место закупорка иглы. Если это произошло:
- Замените иглу (см. ШАГ 6 и ШАГ 2).
- Затем повторите тест на безопасность (ШАГ 3).
• Не используйте шприц-ручку, если препарат все же не выходит из кончика иглы. Используйте новую шприц-ручку.
• Никогда не используйте шприц для извлечения препарата из шприц-ручки.
Если Вы видите пузырьки воздуха
• Вы можете видеть пузырьки воздуха в препарате. Это нормально, они не причинят Вам вреда.
ШАГ 4: Набор дозы
• Используйте шприц-ручку только для введения однократной суточной дозы от 10 до 40 единиц препарата.
• Никогда не набирайте дозу и не нажимайте на кнопку введения дозы без присоединенной иглы. Это может повредить шприц-ручку.
A. Удостоверьтесь в том, что игла присоединена и доза установлена на ‘0’.

B. Вращайте селектор дозы до тех пор, пока указатель дозы не окажется на одной линии с нужной Вам дозой.
• Если Вы провернули селектор дозы дальше нужной Вам дозы, то можно повернуть его назад.
• Если в шприц-ручке нет достаточного количества единиц препарата для нужной Вам дозы, селектор дозы остановится на количестве оставшихся в шприц-ручке единиц препарата.
• Если Вы не можете набрать всю назначенную Вам дозу, используйте новую шприц-ручку или введите оставшиеся в шприц-ручке единицы препарата и используйте новую шприц-ручку для того, чтобы ввести недостающие единицы препарата до полной дозы. Только в этом случае допускается введение оставшейся дозы менее 10 единиц препарата. Всегда используйте другую шприц-ручку Соликва СолоСтар® 10-40, чтобы дополнить необходимую Вам дозу, а не шприц-ручку Соликва СолоСтар® 30-60.
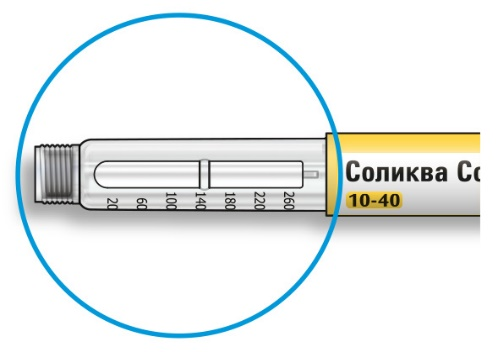
Как читать показания окна дозы
• Не используйте шприц-ручку, если Ваша однократная суточная доза менее 10 единиц препарата, которые показываются в виде белых цифр на черном фоне.

Единицы препарата в шприц-ручке
• Шприц-ручка содержит в общей сложности 300 единиц препарата. Вы может набирать Вашу дозу с шагом в 1 единицу.
• Не используйте эту шприц-ручку, если Вы нуждаетесь в суточной дозе менее 10 единиц или более 40 единиц препарата.
• Каждая шприц-ручка содержит более одной дозы.
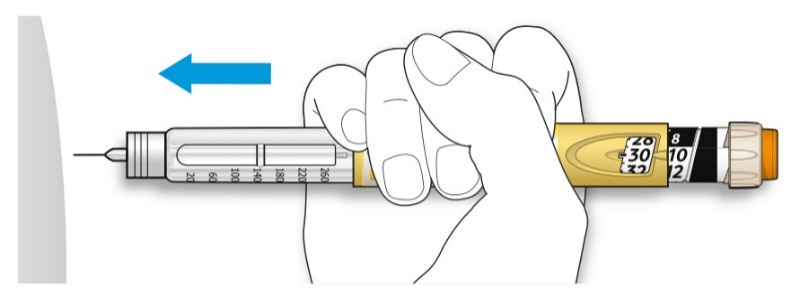
ШАГ 5: Введение дозы
Если Вы испытываете затруднения при нажатии на кнопку ввода дозы, не применяйте силу, так как это может повредить шприц-ручку. За помощью обратитесь к ШАГУ 5E ниже.
A. Выберите место для инъекции, как показано на рисунке выше.
B. Введите иглу в кожу, как Вам было показано Вашим медицинским работником.
• Не прикасайтесь пока к кнопке ввода дозы.
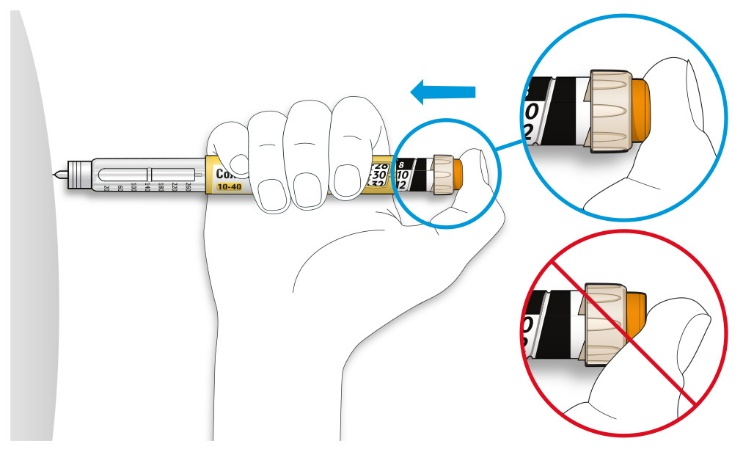
C. Поместите большой палец на кнопку ввода дозы. Затем нажмите до упора и удерживайте в этом положении.
• Не нажимайте на кнопку ввода дозы под углом - большой палец может блокировать проворачивание селектора дозы.
D. Нажимайте на кнопку ввода дозы, и когда вы увидите «0» в окне дозы, медленно досчитайте до 10.
• Это будет гарантировать, что Вы ввели полную дозу.
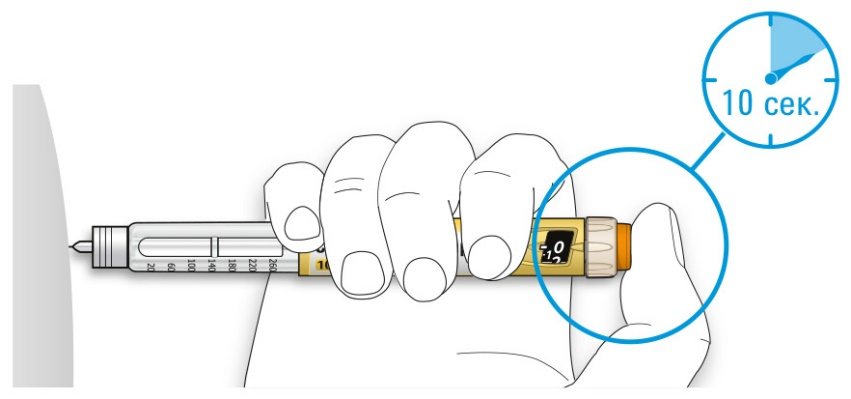
E. После удерживания кнопки ввода дозы и счета до 10 отпустите кнопку ввода. Затем извлеките иглу из кожи.
Если возникают затруднения при нажимании на кнопку ввода
• Смените иглу (см. ШАГ 6 и ШАГ 2), затем проведите тест на безопасность (см. ШАГ 3)
• Если все равно сохраняются затруднения при нажатии на кнопку ввода, возьмите новую шприц-ручку.
• Никогда не используйте шприц для извлечения препарата из шприц-ручки.
ШАГ 6: Удаление иглы
• Будьте осторожны при обращении с иглами - это предотвратит повреждение иглой и перекрестную инфекцию.
• Никогда не надевайте внутренний колпачок иглы назад на использованную иглу.
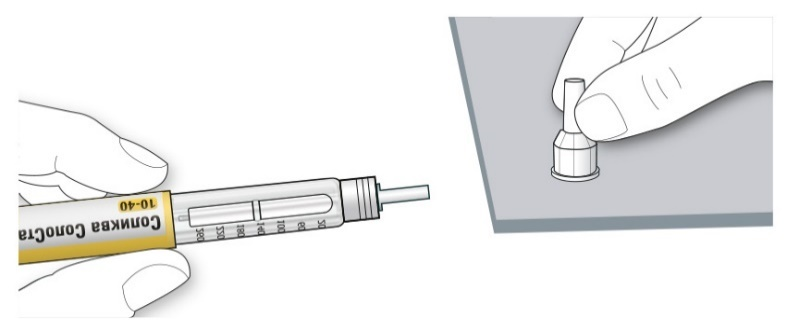
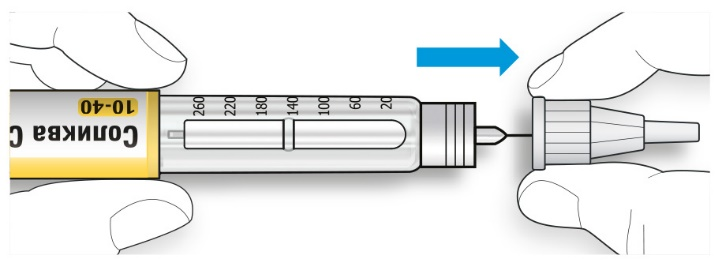
A. Возьмите наружный колпачок иглы двумя пальцами. Держите иглу прямо и введите ее в наружный колпачок иглы.
• Если игла будет введена в колпачок под углом, она может его проткнуть.
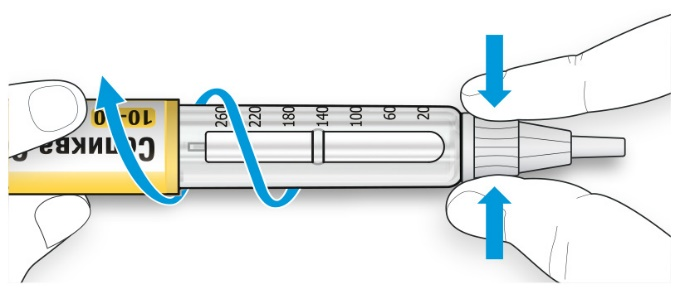
B. Крепко обхватите широкую часть наружного колпачка иглы. Прокрутите Вашу шприц-ручку несколько раз другой рукой, чтобы снять иглу.
• Если игла не снялась с первого раза, повторите попытку.
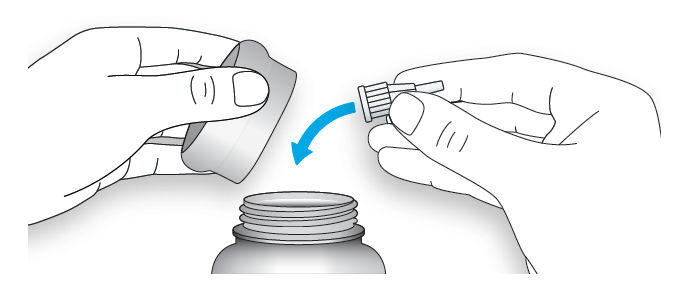
C. Выбросьте использованную иглу в резистентный к проколам контейнер (см. раздел «Утилизация шприц-ручки»).
D. Закройте шприц-ручку ее колпачком
• Не помещайте шприц-ручку в холодильник.
Срок использования
• Шприц-ручку можно применять только в течение 4 недель после начала использования.
Как хранить шприц-ручку
Перед первым использованием
• Храните новые шприц-ручки в холодильнике при температуре 2°C - 8°C.
• Шприц-ручки нельзя замораживать.
После первого использования
• Храните шприц-ручку при температуре ниже 25 °C.
• Не помещайте шприц-ручку обратно в холодильник.
• Не нагревайте шприц-ручку.
• Не подвергайте шприц-ручку воздействию прямого света.
• Никогда не храните шприц-ручку с присоединенной иглой.
• Храните шприц-ручку, закрытой колпачком, для защиты от света.
• Шприц-ручку можно применять только в течение 4 недель после начала использования.
Обращение со шприц-ручкой
Обращайтесь со шприц-ручкой с осторожностью.
• Не роняйте шприц-ручку, избегайте ее удара о твердые поверхности.
• Если Вы думаете, что шприц-ручка, возможно, повреждена, не пытайтесь починить ее, используйте новую шприц-ручку.
Предохраняйте шприц-ручку от попадания пыли и грязи.
• Вы можете очищать наружную поверхность шприц-ручки, протирая ее влажной тканью. Не замачивайте, не мойте и не смазывайте шприц-ручку – это может повредить ее.
Утилизация шприц-ручки
• Снимите иглу, перед тем как выбросить шприц-ручку.
• Утилизируйте использованные шприц-ручки согласно указаниям медицинского работника.
Франция.
АО «Санофи-авентис груп».
54, Рю ля Боэти, 75008 Париж.
тел.: +33 (0)1.53.77.40.00
факс: +33 (0)1.53.77.41.33
адрес электронной почты: www.sanofi.com
7.1 Представитель держателя регистрационного удостоверения
Претензии потребителей направлять по адресу:
Российская Федерация.
Представительство АО «Санофи-авентис груп», Франция.
125009, г. Москва, ул. Тверская, 22.
тел.: +7 (495) 721-14-00.
факс: +7 (495) 721-14-11.
адрес электронной почты: Communication.Russia@sanofi.com
Республика Беларусь.
Представительство АО «Sanofi-Aventis Groupe», Французская Республика.
220004, г. Минск, ул. Димитрова 5, офис 5/2.
тел.: +375-17-203-33-11.
факс: +375-17-203-25-24.
адрес электронной почты: Pharmacovigilance-BY@sanofi.com
Республика Казахстан.
ТОО «Санофи-авентис Казахстан».
050013, г. Алматы, проспект Нурсултан Назарбаев, 187 Б.
тел.: +7(727) 2445096.
адрес электронной почты по вопросам к качеству препарата: quality.info@sanofi.com
адрес электронной почты по вопросам фармаконадзора: Kazakhstan.Pharmacovigilance@sanofi.com
адрес электронной почты по вопросам медицинской информации: Medinfo.Kazakhstan@sanofi.com
8. НОМЕР РЕГИСТРАЦИОННОГО УДОСТОВЕРЕНИЯ
ЛП-№(000323)-(РГ-RU).
9. ДАТА ПЕРВИЧНОЙ РЕГИСТРАЦИИ (ПОДТВЕРЖДЕНИЯ РЕГИСТРАЦИИ, ПЕРЕРЕГИСТРАЦИИ)
Дата первой регистрации: 27 июля 2021 г.
10. ДАТА ПЕРЕСМОТРА ТЕКСТА
Общая характеристика лекарственного препарата Соликва СолоСтар® доступна на информационном портале Евразийского экономического союза в информационно-коммуникационной сети «Интернет» http://www.eurasiancommission.org
MAT-RU-2200144 – 1.0 – 06.2022
Мы получили Вашу заявку и свяжемся с Вами в ближайшее время для подтверждения регистрации
Укажите адрес почты, использованный при регистрации. Мы отправим вам письмо, которое позволит изменить пароль
Нажимая кнопку «Присоединиться», вы подтверждаете свое согласие на обработку компанией Санофи предоставленных вами в форме персональных данных.
Компания Санофи обязуется соблюдать конфиденциальность отправленных вами сообщений. Адрес электронной почты и иная информация, указанная вами в форме, будет использована исключительно для направления ответа на ваше сообщение.
Компания Санофи не будет использовать указанные вами контактные данные для рассылки не запрашиваемых материалов и информации.
Мы получили Вашу заявку и свяжемся с Вами в ближайшее время для подтверждения регистрации
Обращаем Ваше внимание на то, что процесс регистрации не был завершен! Для завершения регистрации Вам необходимо подписать согласие на обработку персональных данных. После этого Вам будут доступны все ресурсы нашего сайта.

Подтвердите свои данные для возобновления доступа. Для этого введите код, отправленный на указанный контакт, и подтвердите сведения о себе.

Вы покидаете ресурс Санофи и переходите на сторонний сайт.
Компания Санофи не несет ответственности за содержание материалов,
размещенных на стороннем ресурсе.
Ссылка:
Подтвердите переход нажатием на кнопку «Перейти» или «Отменить»
